Questões de Concurso Público CNEN 2014 para Técnico em Química
Foram encontradas 35 questões
As propriedades físicas e químicas dos compostos orgânicos, como acidez, pontos de ebulição e fusão, entre outras, dependem de suas funções e estruturas. Analise as seguintes estruturas químicas dos compostos orgânicos.
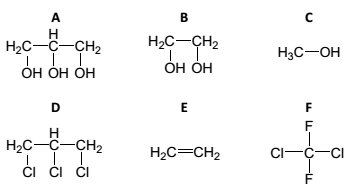
Com base no exposto, assinale a afirmativa INCORRETA.
Sobre as ligações químicas, analise as afirmativas.
I. Nas estruturas de Lewis, a ligação covalente resulta do compartilhamento de um par de elétrons entre dois átomos. Esse compartilhamento é uma característica particular das ligações encontradas na maioria das moléculas orgânicas.
II. Com o desenvolvimento da mecânica quântica, Linus Pauling introduziu o conceito de ressonância para explicar o tipo de situação, em que duas possíveis estruturas de Lewis coexistiriam sob a forma de estruturas ressonantes. Por exemplo, a representação das ligações no O3 é uma média de duas estruturas ressoantes possíveis.
III. Quando ocorre a ligação química pela transferência de elétrons de um átomo (que fica positivo) para outro átomo (que fica negativo), a ligação formada denomina‐se ligação iônica.
Está(ão) correta(s) a(s) afirmativas
Observe a estrutura a seguir, que representa o composto antibiótico conhecido como isopenicilina N, cuja estrutura química possui diversas funções orgânicas.
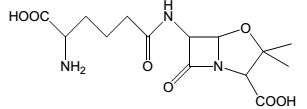
Assinale a alternativa que NÃO contém uma função orgânica representada na estrutura isopenicilina N.
O estudo da tabela periódica mostrou que um grande número de propriedades físicas e químicas variavam conforme a variação do número atômico dos elementos químicos. Estas propriedades são as chamadas propriedades periódicas. Assinale a alternativa INCORRETA acerca das propriedades periódicas.
(Considere apenas elementos neutros e desconsidere os íons.)
No laboratório de química orgânica são realizados, constantemente, diversos processos químicos. Analise os dois processos que representam duas reações orgânicas muito comuns:
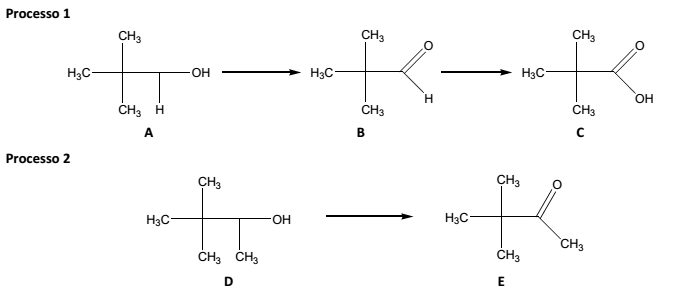
Diante do exposto, é INCORRETO afirmar que o composto
Sobre as ligações químicas, analise as afirmativas.
I. A característica principal das ligações iônicas é a grande diferença de eletronegatividade entre os átomos. Um átomo deve ter baixa energia de ionização e o outro uma elevada afinidade eletrônica.
II. A atração eletrostática entre os íons na ligação iônica é a força mais significativa da estabilização da ligação.
III. A baixa energia de ionização necessária para uma ligação iônica é característica dos metais. A alta energia de afinidade eletrônica, que também é necessária para uma ligação iônica, é uma característica dos elementos químicos não metálicos, que necessitam de um, dois ou três elétrons para completar suas camadas de valência.
Está(ão) correta(s) a(s) afirmativa(s)
Propriedades periódicas são aquelas definidas na tabela periódica, conforme a variação do número atômico (Z) dos elementos químicos. Sobre o tema, marque V para as afirmativas verdadeiras e F para as falsas.
( ) A eletronegatividade diminui no período da esquerda para a direita e na família de baixo para cima.
( ) A eletroafinidade aumenta no período da esquerda para a direita e na família de cima para baixo.
( ) O potencial de ionização diminui no período da direita para a esquerda e na família de cima para baixo.
A sequência está correta em
Para facilitar o trabalho dos químicos, os compostos químicos foram dividos em diversas classes ou funções. Duas funções importantíssimas são os ácidos e as bases. Historicamente, os conceitos que definem os ácidos e as bases mudaram conforme a evolução dos conceitos e o entendimento da química. Diante do exposto, analise as afirmativas.
I. O sueco Svante Arrhenius recebeu o Prêmio Nobel de Química devido aos seus trabalhos de dissociação eletrolítica. Dentro destas teorias, tem‐se as seguintes definições: “ácido é toda substância química que, em água, libera como cátion exclusivamente íons H+” e “base é toda substância química que, em água, libera como ânions exclusivamente íons H+”. Trata‐se da teoria iônica.
II. Em 1923, Johannes Nicolaus Bronsted e Thomas Martin Lowry propuseram, independente, a teoria ácido‐base de Bronsted‐Lowry. Para eles, “ácido é toda substância que libera íons H+” e “base é toda substância que recebe (ou aceita) íons H+”. Trata‐se da teoria protônica.
III. Gilbert Newton Lewis, em 1916, foi um dos grandes responsáveis pelas explicações adequadas sobre as ligações covalentes, a partir do estudo do comportamento dos elétrons. Para Lewis, “ácido é toda substância capaz de aceitar (ou receber pares de elétrons) pares de elétrons de outra substância” e “base é toda substância capaz de doar (ou ceder pares de elétrons) pares de elétrons para outra substância”. Trata‐se da teoria eletrônica.
Está(ão) correta(s) a(s) afirmativa(s)
A figura a seguir apresenta um aparelho típico usado na destilação simples, cujos componentes estão destacados e identificados por letras. Observe.
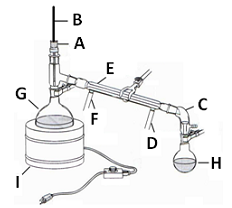
Com base na figura anterior, é INCORRETO afirmar que o(a)
Analise o esquema que mostra um sistema genérico usado para cromotografia líquida de alta eficiência (CLAE ou HPCL – High Performance Liquid Chromatography), a qual, independente do fabricante e do modelo atual, apresenta os seguintes princípios
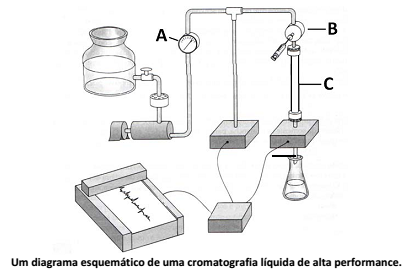
Os componentes identificados pelas letras A, B e C são, respectivamente
Observe a seguir um processo cromatográfico em placa de camada delgada (TLC – Thin Layer Cromatography), cuja amostra contém dois componentes.
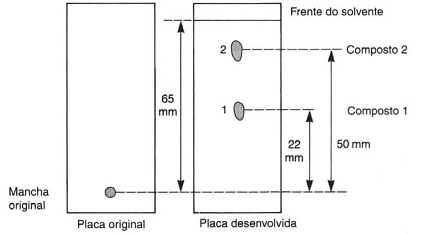
Com base no processo apresentado, é correto afirmar que o
Analise o esquema geral de um cromatógrafo gasoso, o qual, independente dos modelos atuais, apresenta os seguintes princípios da técnica representados:
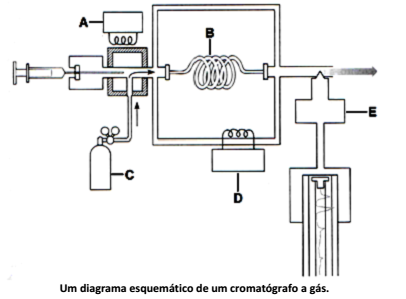
Com base no esquema anterior, é INCORRETO afirmar que o componente identificado pela letra