Questões de Concurso Público Prefeitura de São José - SC 2019 para Engenheiro - Químico
Foram encontradas 24 questões
Sobre o metal mencionado no texto faz-se as seguintes afirmações:
I. Trata-se de um elemento representativo. II. Sua distribuição eletrônica é [Xe] 5p6 6s1 4f14 5d10. III. É isótopo do cátion bivalente platina. IV. Não pode ser oxidado por ser um metal nobre.
São corretas as afirmações:
A reação que ocorre é: Ag2S(s) + Aℓ(s)→ Aℓ2S3(s) + Ag(s)
Utilizando o processo descrito, a massa de prata metálica que será regenerada na superfície de um objeto que contém 5g de sulfeto de prata I é aproximadamente:
As seguintes afirmações são feitas acerca do elemento retratado no texto:
I. Possui eletronegatividade maior que o enxofre. II. Possui raio atômico menor que o flúor. III. Possui potencial de ionização maior que o tungstênio. IV. É um gás a temperatura ambiente.
As seguintes afirmações estão corretas:
Com relação às ligações químicas entre os átomos que compõem a molécula de gás carbônico é correto afirmar:
A substância apresenta a seguinte fórmula estrutural:
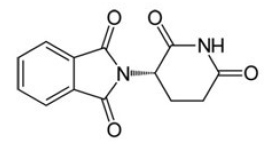
Sobre essa estrutura são realizadas as seguintes afirmações:
I. Apresenta 2 carbonos quirais. II. Tem a função amina na estrutura. III. A sua fórmula molecular é C13H10N2O4. IV. Não apresenta isomeria óptica.
Estão corretas as afirmativas:
C6H14 + O2 → CO2 + H2O
Dados os valores de entalpia de ligação:
LIGAÇÃO ΔHo (kJ/mol) C - H 413 C - C 347 C = O 804 H - O 464 O - O 469
Marque a alternativa que apresenta o valor da combustão de 10g do hexano aproximadamente:
Um químico realizou diversos experimentos para a reação:
2 H2(g) + 2 NO(g) → N2(g) + 2 H2O(g)
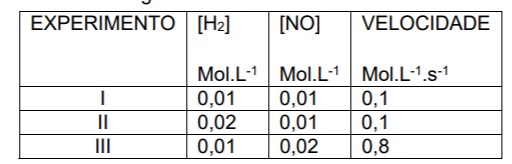
A partir dessa tabela podemos dizer que o valor da constante da velocidade é:
Dado o gráfico:
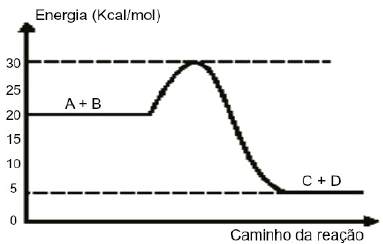
I. Trata-se de um processo exotérmico. II. A energia de ativação corresponde a 10Kcal/mol. III. O valor do complexo ativado é 30Kcal/mol. IV. A presença de um catalisador aumentaria a energia de ativação.
Estão corretas as afirmativas:
I. CH3 – O –CH3 e CH3 – CH2 – OH. II. CH3 – CH = CH – OH e CH3 – CH2 – CHO. III. CH3 – NH – CH2 – CH2 – CH3 e CH3 – CH2 – NH – CH2 – CH3.
As isomerias que correspondem respectivamente a comparação dos compostos I, II e III são:
Analisando a estrutura do paracetamol abaixo:
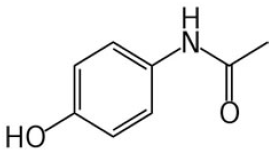
O nome oficial conforme a IUPAC seria:
Considere as representações fornecidas para os átomos A, B e C:
5x+35A12x+15 7x-11B12x-2 6x+13C11x+35
Sabendo que os átomos A e C são isótonos, assinale a
alternativa que indica corretamente os números de
massa dos átomos A, B e C.
FeO(s) + CO(g) → Fe(s) + CO2(g) ∆H = x
Utilizando as equações termoquímicas abaixo e baseando-se na Lei de Hess,
Fe2O3(s) + 3 CO(g) → 2 Fe(s) + 3 CO2(g) ∆H = -25 kJ 3 FeO(s) + CO2(g) → Fe3O4(s) + CO(g) ∆H = -36 kJ 2 Fe3O4(s) + CO2(g) → 3 Fe2O3(s) + CO(g) ∆H = +47 kJ
Partindo de 1 tonelada de óxido ferroso a energia liberada será de aproximadamente quantos kJ?
Dentre as diversas reações para obtenção do metanol uma delas está representada abaixo:
2 H2(g) + CO(g)↔ CH3OH(g)
Sabendo que Kc vale 500 mol-2 . L2, a 27ºC, determine o valor aproximado de Kp a essa mesma temperatura:(Dado: R = 0,082 atm .L . K-1 .mol-1).