Questões de Concurso Público IF-MT 2018 para Química
Foram encontradas 20 questões
Dados: Ka = 8,4 x 10-4 Kw = 1,00 x 10-14 log 8,4 = 0,92
Dado: Massa molar C6H8O7 = 192 g.mol-1 C6H8O7(aq) + 3 OH-(aq) → C6H5O73-(aq) + 3 H2O
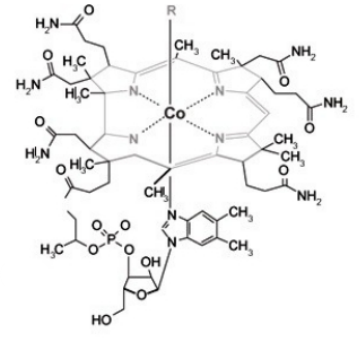
( PANIZ, C. et al, J. Bras. Patol. Med. Lab., v. 41, n.5, p. 323-334, 2005).
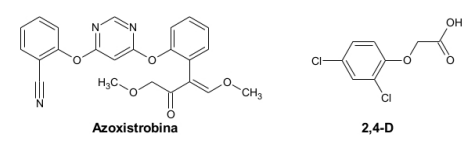
Com base nas estruturas, assinale a alternativa que apresenta a única função orgânica comum aos dois compostos.
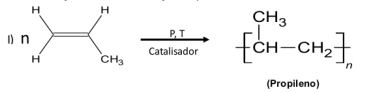
II) HOOC (CH2)4COOH + H2N (CH2)6NH2 → [-OOC (CH2)4CO-NH (CH2)6NH-] + X
(Nylon)
Sobre essas reações, marque V para as afirmativas verdadeiras e F para as falsas.
( ) O propileno é um polímero de adição. ( ) O nylon é um polímero de condensação. ( ) O subproduto X na reação II representa a amônia. ( ) O propileno é um copolímero. ( ) Tanto o propileno quanto o nylon são polímeros de adição.
Assinale a sequência correta:
Dado: 1H; 6C; 7N; 8O;
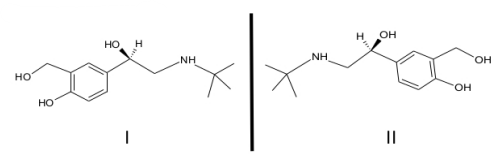
Com base nas estruturas, assinale a alternativa CORRETA.
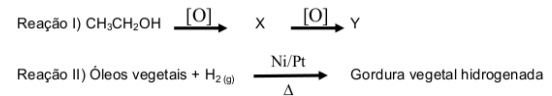
Assinale a alternativa correta quanto às reações orgânicas apresentadas anteriormente.
Cd2+ + 2 e- → Cd Eo red = - 0,40 V
Uma das formas de obtenção do fosfato de cálcio pode ser através da reação:
CaCO3(aq) + Mg3(PO4)2(aq) Ca3(PO4)2(aq) + MgCO3(aq)
Considerando que a reação tem um rendimento de 80%, qual a massa de fosfato de cálcio, em gramas, será obtida quando são utilizados 450 g de carbonato de cálcio (70% de pureza)?
Dados: Ca = 40 g/mol; C = 12 g mol-1 ; O = 16 g mol-1 ; Mg = 24 g mol-1 ; P = 31 g mol-1 ; Ca = 40 g mol-1.
I - Os óxidos ácidos são compostos iônicos, que reagem com bases para formar um sal e água. II - Os óxidos básicos são compostos moleculares, que reagem com ácidos para formar um sal e água. III - O dióxido de carbono (óxido básico), reagem com uma base de Lewis (OH- ), presente em uma solução de NaOH em água, formando o carbonato de sódio. IV - Vários metais do grupo D formam óxidos anfóteros.
Após a análise dos itens, marque a alternativa CORRETA.
Dados: N (Z = 7); Mg (Z = 12); P (Z = 15); S (Z = 16); K (Z = 19); Ca (Z = 20).
Dado: 1 m3 = 1000 L.
( ) O leite, o sangue e o granito são exemplos de misturas heterogêneas. ( ) Água e óleo formam uma mistura heterogênea, por serem miscíveis. ( ) Os componentes da mistura heterogênea formada por água, pedra, limalha de ferro e óleo podem ser separados por filtração, imantação e decantação. ( ) Quando volumes iguais de água e etanol (por exemplo 50mL de cada um) são colocados em um mesmo recipiente, formam uma mistura homogênea. O volume final dessa mistura será maior que a soma dos volumes das duas substâncias, em virtude da quebra das ligações de hidrogênio entre as moléculas da água e a formação destas ligações entre as moléculas das duas substâncias. ( ) As misturas homogêneas são chamadas de soluções.
Assinale a alternativa correta.
I - Os elementos são classificados como representativos (elétrons de valência nos subníveis s ou p) e metais de transição (externa – elétrons de valência no subnivel d; interna – elétrons de valência no subnível f) e isso pode ser observado por meio da distribuição eletrônica. II - Dos 118 elementos presentes nas tabelas periódicas atuais, à temperatura ambiente, a grande maioria são sólidos e somente dois são líquidos: mercúrio e iodo. III - Os elementos fósforo (grupo 15) e cloro (grupo 17) combinam-se por ligações covalentes, formando o pentacloreto de fósforo. Esse composto apresenta geometria pirâmide trigonal e reage violentamente com a água, tendo como um dos produtos o ácido clorídrico. IV - De forma geral, os valores de energia de ionização e afinidade eletrônica, aumentam da esquerda para a direita nos períodos e de cima para baixo nos grupos. V - Os elementos estão presentes, no nosso cotidiano, podendo ser utilizados para a produção de materiais e desempenhar várias funções. A maioria das moléculas que constituem o corpo humano consiste predominantemente de seis elementos, sendo: C, H, O, N, P e Se.
Assinale a alternativa correta.
C2H4(g) + 6 F2(g) → 2 CF4(g) + 4 HF(g)
A partir das entalpias de formação (∆Hof) abaixo:
H2(g) + F2(g) → 2 HF(g) ∆Hof = - 537,6 kJ C(s) + 2 F2(g) → CF4(g) ∆Hof = - 680 kJ 2 C(s) + 2 H2(g) → C2H4(g) ∆Hof = + 52,3 kJ
BROWN, T. L.; LEMAY JR., H. E.; BURSTEN, B. E. Química, a Ciência Central. Tradutor Robson Matos, São Paulo: Pearson Prentice Hall, 2005, 5ª impressão em 2010.
Marque a alternativa que corresponde ao valor de variação de entalpia (∆Hor ) da reação do etileno com o gás flúor.
Dados: H = 1,0 g mol-1; N = 14,0 g mol-1; O = 16,0 g mol-1.