Questões de Concurso Público IF-SP 2019 para Química
Foram encontradas 24 questões
Corrosão eletroquímica de um metal é um processo que envolve reações redox espontâneas, como exemplo, a indesejada ferrugem. Esta é originada do processo corrosivo do ferro. Um procedimento para evitar a corrosão é a adição de um metal de sacrifício para ser ______________ preferencialmente por apresentar um ___________ potencial de ____________.
Assinale a alternativa que completa o texto acima corretamente.
Considerando a reação de formação do trióxido de enxofre no equilíbrio e sob temperatura e pressão constantes, é correto afirmar que:
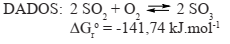
Em um experimento de laboratório, uma aluna foi solicitada a ordenar 3 elementos (A, B, C) de acordo com seus potenciais de redução. Para isso, realizou o seguinte procedimento: adicionou um pedaço de metal (A, B, C) em soluções aquosas contendo os cátions dos outros metais (A+, B2+, C2+) e também em solução ácida e observou onde ocorreu reação. Ao fim do experimento, elaborou uma tabela onde indicou com X os sistemas onde ocorreram reação com deposição de metal ou desprendimento de H2 , tendo obtido a seguinte tabela:
Ao organizar as espécies iônicas por ordem crescente de potencial de redução, com base no procedimento adotado e nos resultados tabelados, têm-se:
Para determinar o teor de prata em uma liga, realizou-se um procedimento de gravimetria. Tal procedimento partiu de uma amostra da liga de 5g à qual foi submetida a abertura com ácido nítrico seguido de tratamento com solução de cloreto de sódio. Ao fim do procedimento foram obtidos 4,3g de precipitado. A partir dessas informações pode-se constatar que o teor de prata na liga analisada era, aproximadamente, de:
Considere as seguintes massas molares em g. mol-1: Na = 23, Cℓ = 35, Ag = 108).
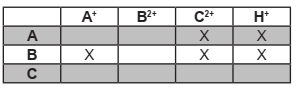
Uma das etapas da síntese da droga Sofosbuvirr consiste na proteção da hidroxila do material de partida, a lactona, com brometo de benzila (BnBr), segundo o esquema abaixo:
De acordo com as informações a reação pode ser
classificada como:
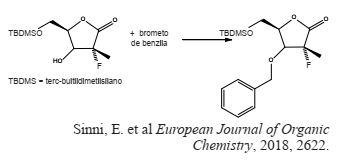
Considere os potenciais padrões de redução apresentados abaixo:
Identifique nas reações abaixo, a que é classificada
como um processo espontâneo.
São apresentados na tabela abaixo os valores de entalpia de vaporização e os pontos de ebulição de algumas substâncias:
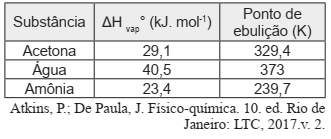
A entropia de vaporização, ΔS vap, da acetona, água e
amônia em J.K-1.mol -1, são, respectivamente:
Cristais macroscópicos idiomórficos podem ser produzidos pela evaporação de água à temperatura ambiente de soluções aquosas supersaturadas. As solubilidades, a 20ºC, de alguns sais e sua respectiva toxicidade podem ser vistas na tabela abaixo:
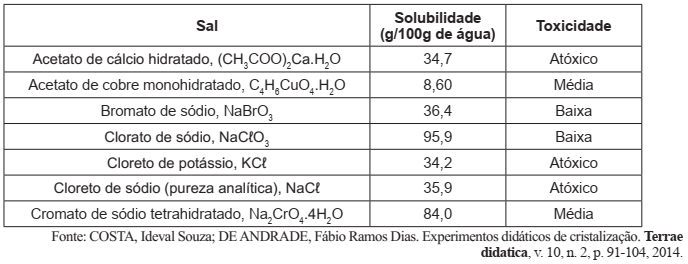
De acordo com os dados acima é correto afirmar que:
O artigo O preparo do sabão de cinzas em Minas Gerais, Brasil: do status de Etnociência à sua mediação para a sala de aula utilizando um sistema hipermídia etnográfico, publicado na revista Investigações em Ensino de Ciências – V15(2), pp. 355-383, 2010, apresenta algumas das principais concepções relacionadas ao saber popular, à etnociência e à química da saponificação. O artigo retrata algumas falas típicas das mulheres que produzem o sabão de cinzas.
Sabendo-se que a “dicuada”, trata-se de um líquido obtido a partir das cinzas de madeira queimada. Em relação à fala: “A dicuada é que corta a gordura”, pode-se afirmar que:
O gráfico apresentado a seguir relaciona os pontos de ebulição dos compostos formados por elementos da família 5A e hidrogênio em função do número atômico do elemento.

As propriedades que explicam os fatos de o ponto
de ebulição da amônia ser maior que o da fosfina e
menor que o do hidreto de bismuto (III) são:
Pesquisadores japoneses identificaram uma enzima, chamada de PETase, capaz de promover a transformação do polímero poli-tereftalato de etileno em 1,2-etanodiol e ácido tereftálico.
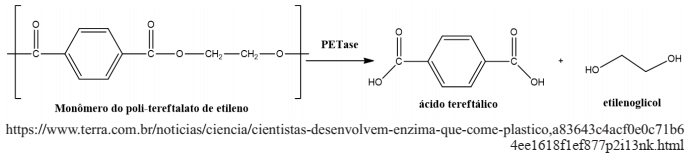
Considere que uma amostra de 1 tonelada de garrafas PET contenha o polímero na forma pura. Após a ação
da enzima, qual o volume de etilenoglicol, em L, produzido, sabendo que a densidade desse diol é 1,11
g.cm-3 e que as massas atômicas são: C = 12, H = 1 e O = 16?
A forma como alguns temas são abordados no ensino de química, leva o estudante a imaginar química como uma ciência abstrata, dificultando o processo de ensino e aprendizagem. Para o ensino do conteúdo de modelos moleculares pode-se fazer uso de métodos alternativos didáticos que promovam a melhor visualização das ligações químicas entre átomos e a consequente formação de moléculas e seu arranjo espacial.
A tabela abaixo mostra a relação dos diferentes tipos de átomos com respectivos ângulos de ligação e formato destes no modelo:
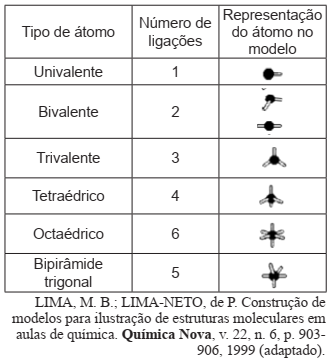
Com base nessas informações e em seus conhecimentos sobre geometria molecular, pode-se afirmar que, a geometria molecular:
“O boro forma uma série notável de compostos binários com o hidrogênio – os boranos. Esses compostos incluem o diborano, B2 H6 , e compostos mais complexos, como o decaborano, B10H14”
(JONES, L.; ATKINS, P. Princípios de química: questionando a vida moderna e o meio ambiente. 5. ed. Porto Alegre: Bookman. 2011.p.632)
Moléculas como o diborano são deficientes em elétrons e, por isso, não podemos escrever estruturas de Lewis válidas. Duas ligações B-H-B são formadas na molécula, formando pontes de hidrogênio. Esse padrão de ligação também é visto no hidrogênio protonado (H3 + ), por exemplo. Como são conhecidas ligações como as pontes presentes no diborano?
O Cloreto de alumínio sólido é um ácido de Lewis muito utilizado nas reações de substituição orgânica.
O valor da entalpia padrão de formação deste ácido de Lewis encontra-se entre:
Dados:
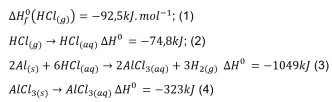
(Fonte: ATKINS, Peter; JONES, Loretta; LAVERMAN,
Leroy. Princípios de Química: Questionando a Vida
Moderna e o Meio Ambiente. Bookman Editora, 2018)
Uma amostra contendo 514 mg de C8 H18, um dos componentes da gasolina, foi colocada em um calorímetro com oxigênio suficiente para promover a combustão completa. O calorímetro foi preenchido com 1,8 L de água e a capacidade calorífica do interior do calorímetro (sem água) é 1,06 kJ.°C-1. A reação promove uma variação de temperatura de 2,8 °C.
Dados: Capacidade calorífica molar da água = 75,3 J.°C-1.mol-1.
Massas atômicas: C=12; H=1
Qual é o calor de combustão por mol, aproximado, de C8 H18?
Em um laboratório, preparou-se uma solução básica de NaOH, pesando-se uma determinada massa do reagente. Visto que o NaOH tem propriedade higroscópica, esta solução foi padronizada com um padrão primário, biftalato ácido de potássio. Para este procedimento, utilizou-se 25mL da solução de NaOH preparada e titulou-se com biftalato ácido de potássio. A massa de biftalato de potássio utilizada para padronização foi de 0,4000g. A reação entre titulante e titulado, pode ser representada pela equação:
KHC8H4O4(s) + NaOH(aq) → KNaC8H4O4(aq) + H2O(l)
Uma reação do tipo 2A(g) + Z(g) →2T(g) foi monitorada variando-se a concentração dos reagentes. A velocidade de formação de T foi medida conforme a tabela abaixo.
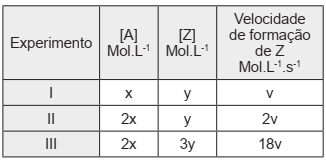
Determine a lei de velocidade e calcule a velocidade da reação em função de v se [A] for x e [Z]
for 3y.