Questões de Concurso Público IF-TO 2021 para Professor EBTT - Química
Foram encontradas 22 questões
Matéria é um agregado de partículas que possui propriedades que permite ser identificada e classificada. A seguir é dado um quadro com amostras de matérias e algumas propriedades.
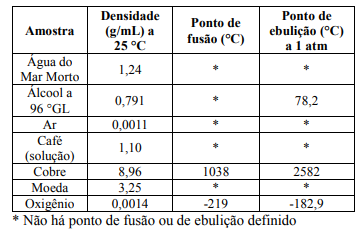
Sobre as substâncias do quadro foram feitas as seguintes proposições:
I. Cobre e moeda são substâncias simples.
II. Água do Mar Morto é uma mistura.
III. A massa de 50 mL de água do Mar Morto é de 62 g.
IV. O ar é basicamente uma mistura homogênea entre o oxigênio e nitrogênio.
V. Densidade, ponto de fusão e de ebulição são propriedades físicas da matéria.
Assinale a alternativa que contém a análise correta.
“Na nova fábrica, a água salobra e a água de processo pré-tratada da indústria são preparadas para a água doce. Isso é possível graças à combinação de diferentes técnicas de processamento da Apateq, incluindo software personalizado, desenvolvido ao longo dos anos”.
(Disponível em: https://tratamentodeagua.com.br/europa-reutilizacao-direta-agua/. Acessado em 28/09/2021)
Para este tratamento ser possível, além dos processos já praticados nas estações de tratamento de águas (ETA), foram adicionados mais dois processos de separação, que são eles:
A ureia ((NH2)2CO) é um composto orgânico, sólido, cristalino e solúvel em água. Ela tem diversas aplicações, como na alimentação de bovinos, estabilizador de explosivos, produção de resinas e medicamentos e até nas sínteses de fertilizantes agrícolas.
Um dos meios de se obter a ureia e água é pela reação entre gás carbônico e amônia, nas condições adequadas.
Com base no texto, é correto afirmar que:
A respeito dos postulados de Bohr, analise os seguintes itens:
I. Cada elétron apresenta uma quantidade específica de energia.
II. Um elétron absorve ou irradia energia conforme salta de uma órbita para outra. Se um elétron absorveu energia significa que ele saltou para uma órbita mais próxima do núcleo.
III. Para que o elétron permaneça em sua órbita a atração eletrostática entre o núcleo e o elétron deve ser igual a força centrífuga.
Assinale a alternativa que contém a análise correta.
NH3(g) + H2O(ℓ) ⇄ NH4+(aq) + OH-(aq)
Com relação à amônia e a sua reação com água, analise os seguintes itens:
I. A geometria molecular da amônia é piramidal. II. A amônia é dita como base de Bronsted-Lowry na reação com a água. III. NH4+ é a base conjugada da amônia.
Assinale a alternativa que contém a análise correta.
“A plataforma do Instituto Nacional de Meteorologia (Inmet) que monitora as maiores temperaturas registradas no Brasil a cada 24h, mostra que cinco cidades do Tocantins estavam entre as 10 mais quentes do Brasil nesta quinta-feira (26/8)”.
(Disponível em: https://afnoticias.com.br/estado/um-sol-pra-cada-um-5-cidades-do-tocantins-ficam-no-top-10-das-mais-quentes-do-pais. Acessado em 28/09/2021)
Em um estado tão quente quanto o Tocantins, buscamos alternativas para amenizar o calor, como as piscinas. Porém, é necessário mantê-las limpas para uso. Durante o tratamento da água da piscina é utilizado o sulfato de alumínio Al2 (SO4)3.
A obtenção de sulfato de alumínio se dá pela reação do alumínio sólido (Al) com o ácido sulfúrico (H2SO4 ). Considerando os dois reagentes puros, nas condições normais de temperatura e pressão (CNTP), qual o volume, em litros, de gás formado durante a preparação de 114 g de Al₂ (SO₄ )₃?
(Disponível em: https://jovempan.com.br/noticias/brasil/gas-de-cozinha-atinge-maior-preco-em-2021-e-deve-ficar-ainda- mais-caro-entenda-o-reajuste-da-petrobras.html. Acessado em 28/09/2021)
Supondo que todo o GLP presente no botijão seja somente butano e está totalmente na forma líquida, e que o preço do botijão de gás seja de R$ 125,00, para uma família que teve um gasto mensal com a fatura de gás de R$ 55,77, qual a quantidade de energia que foi liberada, em quilojoules, na queima do gás butano?
A reação de combustão completa do butano (não balanceada):
C₄H₁₀(g) → CO₂ (g) + H₂O ∆H°C = 2.808 kJ/mol
O dióxido de nitrogênio (NO₂ ) é uma molécula intermediária na produção industrial de ácido nítrico (HNO₃ ), que é muito aplicado na produção de fertilizantes. O dióxido de nitrogênio existe em equilíbrio com o tetróxido de nitrogênio (N₂O₄ ), segundo a reação:
2NO₂(g) ⇄ N₂O₄(g) ∆H = −57,23 kJ/mol
Para aumentar o rendimento do dióxido de
nitrogênio na reação, segundo o princípio de Le
Châtelier, deve-se:
I. A equação
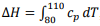 , pode ser usada para
calcular a variação da entalpia associado ao
aquecimento de um mol da substância. II. Se a substância for um líquido ou sólido, o
processo de aquecimento terá praticamente o
mesmo gasto energético a volume constante e
a pressão constante.
III. Se a substância for um gás ideal, o processo de
aquecimento a pressão constante gastará mais
energia que o processo de aquecimento a
volume constante.
, pode ser usada para
calcular a variação da entalpia associado ao
aquecimento de um mol da substância. II. Se a substância for um líquido ou sólido, o
processo de aquecimento terá praticamente o
mesmo gasto energético a volume constante e
a pressão constante.
III. Se a substância for um gás ideal, o processo de
aquecimento a pressão constante gastará mais
energia que o processo de aquecimento a
volume constante. Assinale a alternativa que contém a análise correta.
Quimicamente, a cloroquina (CQ) e a hidroxicloroquina (HCQ) pertencem à classe das 4- aminoquinodinas. Elas têm estrutura central aromática comum, com um cloro na posição 7, ligada às respectivas cadeias laterais básicas. A forma molecular da cloroquina é: C18H26CIN3, com massa molar de 319,9 g/mol. Já a hidroxicloroquina tem massa molar de 335,9 g/mol.
A CQ e a HCQ são administradas como difosfato e sulfato, respectivamente, em suas formas racêmicas.
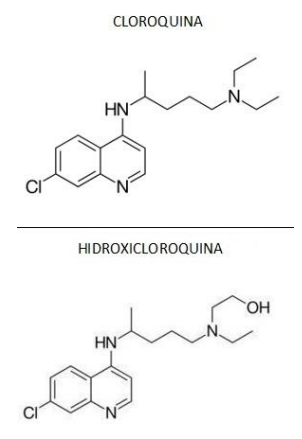
Sobre o medicamento citado acima, marque o que
for correto.
As termobalanças são instrumentos que permitem a pesagem contínua de uma amostra em função da temperatura, ou seja, a medida em que ela é aquecida ou resfriada.
As curvas de variação de massa (em geral perda, mais raramente ganho de massa) em função da temperatura permitem tirar conclusões sobre a estabilidade térmica da amostra, sobre a composição e estabilidade dos compostos intermediários e sobre a composição de resíduo.
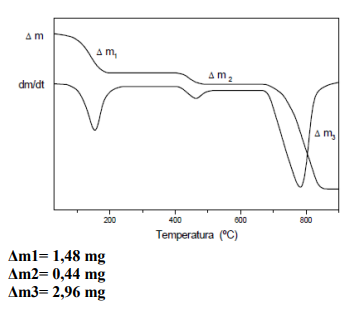
Sabendo que a curva de variação de massa acima é de uma amostra de CaMg(CO3)2 ou Ca(CO3) + Mg(CO3) de massa 10 mg, tendo a primeira perda de massa da amostra referente a águas de hidratação, que posteriormente ocorrem a formação dos resíduos óxido de magnésio e óxido de cálcio separadamente e respectivamente. Qual o percentual de óxido de magnésio formado?
etanol hidratado 96% (porcentagem em volume) água desnaturante (quantidade desprezível).
Em uma das bateladas de 1000 litros de produto, o analista de controle de qualidade identificou que a concentração alcoólica estava em 70% em volume. O que o operador deve fazer, desconsiderando as possíveis contrações ou dilatações de volume, para que a indústria entregue um produto com concentração próxima e não inferior a 70% INPM (equivalente à 74,5% em volume)?
Dados de densidade: água= 1,0g/mL; etanol= 0,8g/mL.
Um estudante misturou 200mL de solução de ácido HX de concentração 0,1mol/L com 300mL de solução do sal de sódio desse ácido (NaX) que tinha concentração de 0,2mol/L. Sabendo que a constante de ionização do ácido HX é 0,000003. Qual o valor do pH da solução formada?
I. Uma amostra de um sólido orgânico de alta pureza a ser analisado para identificar as possíveis funções orgânicas presentes em sua molécula.
II. Uma amostra de um composto orgânico analisada para contribuir na elucidação da estrutura da molécula a partir dos seus fragmentos que geram respostas de razão massa-carga.
III. Determinação da concentração de uma espécie conhecida, a partir da simples relação linear entre absorção da radiação eletromagnética e concentração.
IV. Injeção de uma amostra em uma chama, provocando a excitação eletrônica dos átomos, gerando um sinal analítico através da radiação UV-Vis gerada.
As situações descritas acima estão relacionadas, respectivamente, com as técnicas de:
Sobre as limitações de modelos explicativos, identifique os modelos atômicos nas afirmações abaixo:
I. Não explica as conclusões do experimento de Geiger–Marsden que consiste em um feixe de partículas alfa, normalmente executado em uma folha de ouro muito fina em uma câmara evacuada.
II. Não explica a natureza elétrica da Matéria.
III. Não explica o espectro de raia, formado por elementos multieletrônicos.
IV. Não está em acordo com a teoria do eletromagnetismo, que aponta que toda partícula com carga elétrica submetida a uma aceleração origina a emissão de uma onda eletromagnética.
As limitações apresentadas acima são, respectivamente, dos modelos atômicos:
Identifique os tipos de reações a seguir:
I. CH3-CH2-(CH3)2C-Cl + OH- → CH3-CH2-(CH3)2→C-OH + Cl-
II. CH3-CH2-(CH3)2C-OH + H2SO4 → CH3-CH=C(CH3)2 + H2O + H2SO4
III. III. CH3-CH2-CH2-Cl + OH- → CH3-CH2-CH2- OH + Cl-
IV. CH3-CH2-CH=CH2 + HBr → CH3-CH2-CH(Br)- CH3
V. HOOC-(CH2)4-COOH + H2N-(CH2)6-NH2 → nH2O + [-NH-(CH2)6-NH-CO-(CH2)4-CO-]n
As reações expostas são, respectivamente:
O trabalho em um laboratório envolve necessariamente um grau de risco; acidentes podem acontecer e acontecem. A adoção rigorosa das normas contribui na prevenção (ou minimização dos efeitos) de acidentes.
Analise as possíveis situações que podem ocorrer e analise as ações tomadas.
I. Uma estudante derramou uma quantidade considerável de ácido acético glacial em sua blusa. No socorro, ela deve ter sua intimidade preservada, portanto deve-se encaminhar a estudante para um banheiro feminino mais próximo para enxágue com água corrente e posteriormente à sala do médico ou enfermeiro da unidade.
II. Para qualquer tipo de acidente, faz-se
necessário procurar o responsável técnico ou
comissão de saúde e segurança do trabalho da
instituição para que as ações de socorro
possam ser executadas conforme o padrão da
instituição.
III. Usuários do laboratório de química que utilizam lentes de contato só podem executar ou acompanhar experimentos se fizerem o uso de óculos de proteção.
IV. No laboratório não se deve levar comida ou bebida. Não tomar líquidos em recipientes de vidro de laboratório. Não fumar no laboratório.
Das situações apresentadas acima, estão corretas:
Alguns procedimentos de laboratório podem parecer simples, porém para que sejam feitos de maneira correta e segura faz-se necessário ter atenção a uma série de detalhes.
Um professor orienta para que os estudantes façam
100 mL de uma solução de NaOH 0,01 mol/L.
Faça os cálculos previamente, tendo atenção na pureza do reagente.
Pese rapidamente a quantidade calculada de
hidróxido de sódio em lentilhas em um béquer,
evitando que o frasco do reagente fique aberto por
muito tempo.
Adicione em torno de 50mL de água destilada no béquer com NaOH, dissolva bem e espere esfriar. Transfira para o balão volumétrico de 100mL utilizando funil, adicione pequenas alíquotas de água destilada no béquer transferindo-as para balão através do funil de forma que o volume não seja completo.
Adicione água destilada até que o menisco fique
próximo da marca de aferição. Faça a aferição do
menisco gotejando com pipeta de Pasteur. Tampe o
balão, faça a homogeneização.
Sobre as instruções do professor, é correto afirmar, exceto: