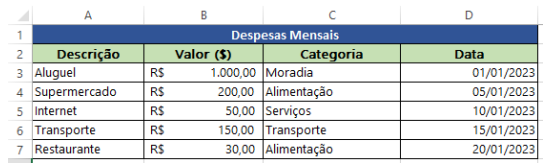
Mudanças na operação da propaganda comercial
Em seus começos, em fins do século XIX, a propaganda comercial sublinhava e elogiava as qualidades do produto: apresentava, por exemplo, os efeitos curativos dos remédios, o conforto de uma mobília, o bom gosto de uma peça de roupa em moda. Como na era da sociedade industrial os produtos eram valorizados por sua durabilidade, a propaganda tendia __I__ inventar uma imagem duradoura que garantisse o reconhecimento imediato do produto e fosse facilmente repetida. Essa “marca” podia ser um desenho, um slogan, uma pequena melodia, uma rima. A propaganda também buscava afirmar o produto trazendo o nome do fabricante como garantia da qualidade ou da exclusividade.
Para entendermos a mudança ocorrida na forma da propaganda, precisamos levar em conta a passagem da sociedade industrial __II__ pós-industrial. Com o aumento da competição entre produtores e distribuidores, com o crescimento do mercado da moda (que não se restringe mais ao vestuário) e, sobretudo, __III__ medida que pesquisas de mercado indicavam que as vendas dependiam da capacidade de manipular desejos do consumidor e até mesmo de criar desejos nele, a propaganda comercial foi deixando de apresentar o produto propriamente dito (com suas propriedades, qualidades, durabilidade) para afirmar os desejos que ele realizaria: sucesso, prosperidade, segurança, juventude eterna, beleza, atração sexual, felicidade. Em outras palavras, a propaganda ou publicidade comercial passou __IV__ vender imagens e signos, e não as próprias mercadorias.
Por exemplo, em lugar do sabonete e do desodorante, surge a imagem da sensualidade da mulher ou do homem que os usam. O automóvel é apresentado como prova de sucesso, charme e inteligência do consumidor.
A propaganda comercial também se apropria de atitudes, opiniões e posições críticas ou radicais existentes na sociedade, esvaziando seu conteúdo social ou político para investi-las num produto, transformando-as em moda consumível e passageira. Feminismo, guerrilha revolucionária, movimentos de periferia são transformados em qualidades que vendem produtos.
Mas a publicidade não se contenta em construir imagens com as quais o consumidor é induzido a identificar-se. Ela as apresenta como realização de desejos que ele nem sabia que tinha e que passa a ter – uma roupa ou um perfume são associados a viagens a países distantes e exóticos ou a uma relação sexual fantástica; um utensílio doméstico ou um sabão em pó são apresentados como a suprema defesa do feminismo, liberando a mulher das penas caseiras; etc.
(CHAUI, Marilena. Iniciação à filosofia – 2. Ed. Ática, 2014. Adaptado.)