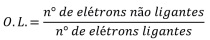Questões de Concurso Público CRQ - 12ª Região (GO, TO e DF) 2024 para Agente Fiscal
Foram encontradas 60 questões

Internet:<www.tabelaperiodica.org>
Acerca da estequiometria, julgue o item.
Um mol é definido como a quantidade de átomos
presente em exatamente 12 gramas de átomos de
carbono‑12 (
12C).

Internet:<www.tabelaperiodica.org>
Acerca da estequiometria, julgue o item.
Para obter 0,2 mol de FeCl3
, é necessário que se
pesem aproximadamente 3,24 g do sólido.

Internet:<www.tabelaperiodica.org>
Acerca da estequiometria, julgue o item.
A massa aproximada de 6,022 x 1023 moléculas de
tetracloreto de carbono é de 154 g.

Internet:<www.tabelaperiodica.org>
Acerca da estequiometria, julgue o item.
Na reação em que duas moléculas de octano
reagem com 25 moléculas de oxigênio, são formadas
16 moléculas de dióxido de carbono e 18 moléculas
de água.

Internet:<www.tabelaperiodica.org>
Acerca da estequiometria, julgue o item.
Ao balancear uma equação química, é aconselhável
começar sempre com H2
e O2
. O balanceamento da
fórmula mais complexa deve ser deixado para o final.

Internet:<www.tabelaperiodica.org>
Em relação à termodinâmica química, julgue o item.
Toda transformação isocórica ocorre com pressão
constante.

Internet:<www.tabelaperiodica.org>
Em relação à termodinâmica química, julgue o item.
A primeira lei da termodinâmica afirma que a energia
total em um sistema isolado é constante, podendo
apenas ser transformada de uma forma para outra.

Internet:<www.tabelaperiodica.org>
Em relação à termodinâmica química, julgue o item.
Em uma reação química realizada à pressão constante,
quando o sistema libera 60 kJ.mol‑1 de energia na
forma de calor (Q) e realiza 10 kJ.mol‑1 de trabalho
de expansão (W), a variação da energia interna é
de ‑70 kJ.mol‑1.

Internet:<www.tabelaperiodica.org>
Em relação à termodinâmica química, julgue o item.
Em uma reação química conduzida à pressão
constante, se o sistema liberar 45 kJ.mol‑1 de calor (Q)
e realizar 20 kJ.mol‑1 de trabalho de expansão (W), a
variação da entalpia será de ‑45 kJ.mol‑1.

Internet:<www.tabelaperiodica.org>
Em relação à termodinâmica química, julgue o item.
A entalpia não é uma função de estado, o que significa
que sua variação depende do caminho percorrido, e
não apenas dos estados inicial e final.

Internet:<www.tabelaperiodica.org>
Quanto às ligações químicas, julgue o item.
Pelo ciclo de Born‑Haber, é possível calcular a energia
de rede, que é a energia liberada quando os íons são
reunidos a partir de uma separação infinita, formando
um mol de composto sólido.

Internet:<www.tabelaperiodica.org>
Quanto às ligações químicas, julgue o item.
Compostos iônicos, geralmente, possuem pontos de
fusão e ebulição baixos, pois os íons são unidos por
forças eletrostáticas, e não por ligação covalente.

Internet:<www.tabelaperiodica.org>
Quanto às ligações químicas, julgue o item.
Todos os compostos iônicos são condutores de
eletricidade, independentemente do estado de
agregação.

Internet:<www.tabelaperiodica.org>
Quanto às ligações químicas, julgue o item.
A energia de rede independe do raio iônico.

Internet:<www.tabelaperiodica.org>
Quanto às ligações químicas, julgue o item.
No gráfico de potencial de Morse, a energia
da molécula atinge um mínimo quando há um
balanceamento entre as atrações e as repulsões.

Internet:<www.tabelaperiodica.org>
Quanto às ligações químicas, julgue o item.
A ligação sigma (σ) é formada pela sobreposição
frontal dos orbitais atômicos.

Internet:<www.tabelaperiodica.org>
Quanto às ligações químicas, julgue o item.
Na ligação covalente, a carga formal corresponde ao
número de oxidação dos átomos.

Internet:<www.tabelaperiodica.org>
Quanto às ligações químicas, julgue o item.
No ácido sulfúrico, existem somente ligações
sigmas (σ).

Internet:<www.tabelaperiodica.org>
Quanto às ligações químicas, julgue o item.
Na teoria do orbital molecular, o diagrama de níveis
de energia indica que a ligação entre dois átomos de
hélio resulta em uma ordem de ligação de zero.

Internet:<www.tabelaperiodica.org>
Quanto às ligações químicas, julgue o item.
Na teoria do orbital molecular, a ordem de ligação (O.L) é calculada por meio da equação a seguir.