Questões de Concurso Público EMGEPRON 2021 para Químico (Fabril Farmacêutico)
Foram encontradas 30 questões
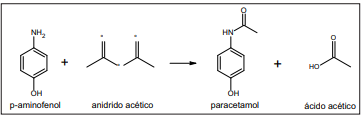
Sabendo que o rendimento dessa síntese é de 65%, o número de mols de paracetamol obtido a partir de 2,18 toneladas de p-aminofenol em excesso de anidrido acético é: (Dados: p-aminofenol = 109 g/mol; paracetamol = 151 g/mol)
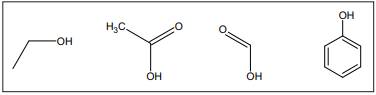
Em uma reação de esterificação, o pKa do catalisador é um fator muito importante para o melhor rendimento do produto de interesse. Dentre os compostos apresentados, a ordem crescente de pKa é:
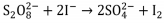
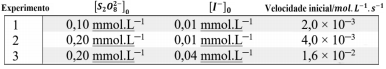
De acordo com a reação química balanceada e os dados experimentais de velocidade, a lei de velocidade experimental é:
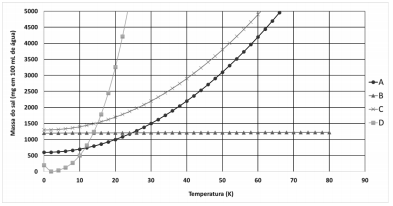
Considerando, esses dados, é possível concluir que, em 10 ºC e com concentração 5g/L, a única solução saturada sem nenhum corpo de fundo é a solução do sal:
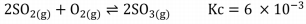
Considerando que a reação foi mantida em um recipiente de 2 L a 300K e as quantidades de dióxido de enxofre e de oxigênio no equilíbrio são 0,2 e 1,2 mols respectivamente, a concentração molar do produto obtido no equilíbrio é de:
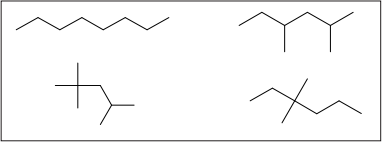
O ponto de ebulição é um fator muito importante para escolher um bom combustível, isso porque quanto maior a pressão de vapor, maior o rendimento de combustão no motor. Dessa forma, pensando somente no ponto de ebulição, entre os quatro hidrocarbonetos na figura, aquele que pode ser considerado o melhor combustível é o:

A pilha que apresenta maior diferença de potencial padrão pode ser representada esquematicamente por:
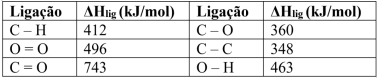
Sabendo que o etanol é vaporizado (ΔHvap = 43,5 kJ/mol) no motor de combustão antes da sua reação com o oxigênio, a entalpia de combustão do etanol líquido é:
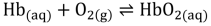
(Onde Hb é a hemoglobina e HbO é oxi- 2 hemoglobina.) O rendimento físico de um atleta está ligado, entre outros fatores, à capacidade de metabolizar oxigênio, o que pode ser prejudicado pela altitude na qual a atividade física está sendo realizada. Assim, um atleta acostumado a treinar no Rio de Janeiro (nível do mar) tem seus resultados físicos prejudicados quando compete na Cidade do México (2250 m acima do nível do mar) pois, nessa altitude, a pressão:
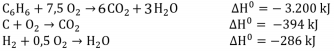
Conclui-se que o ΔH de formação do benzeno é:
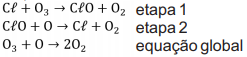
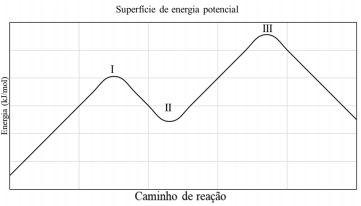
Ao comparar o mecanismo com a SEP, pode-se concluir que a espécie II indicada no diagrama é o:
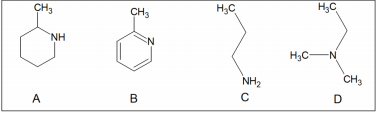
Os compostos de coordenação podem ser entendidos como o produto da reação entre um ácido de Lewis, o centro metálico, e uma base de Lewis, o ligante. Analisando a estrutura desses ligantes entende-se que quanto maior a basicidade mais forte é a interação entre ligante e metal, ou seja, maior força de ligação. Considerando o mesmo centro metálico, a ordem crescente de força de ligação em relação aos ligantes é: