Questões de Concurso Público EMGEPRON 2021 para Químico (Industrial)
Foram encontradas 30 questões
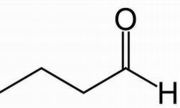
Essa substância pertence à função orgânica oxigenada denominada:
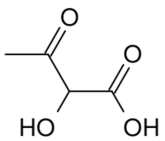
O número de isômeros ópticos ativos correspondentes a essa estrutura é igual a:
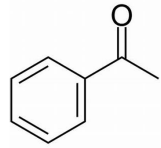
Este composto é obtido a partir da reação do benzeno e um composto X catalisado por AlCl3 O composto X é nomeado como:
CaCO3 (S) → CaO (S) + CO2 (g) ΔH° = 180 kJ/mol
O calor consumido na decomposição de 500 g de CaCO3 é igual a:
Dado: massa molar do CaCO3 = 100 g/mol
2 NO2 (g) → 2 NO (g) + O2 (g)
Em um experimento, realizou-se a reação de decomposição de 460 g de NO2 , obtendo-se 128 g de O2 . O rendimento desta reação foi de:
Dados: NO2 = 46 g/mol O2 = 32 g/mol
A concentração, em mol/L, da solução formada é igual a:
Dado: NaOH = 40 g/mol
O íon complexo [Zn(NH3)]+2 é formado a partir 3 4 da seguinte reação química:
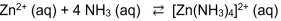
Em um experimento, ao se atingir o equilíbrio químico, as concentrações dos participantes da reação são apresentadas na tabela a seguir.
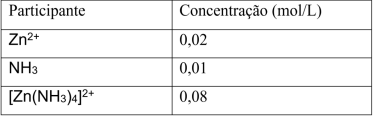
A constante de equilíbrio dessa reação é igual a:
2 H2O2 (aq) → 2 H2O (l) + O2 (g)
Em um estudo cinético dessa reação, mediu-se a velocidade da reação em dois experimentos nos quais se variou a concentração inicial de H2O2, conforme apresentado a seguir:
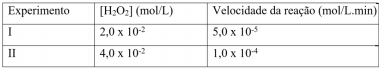
A constante de velocidade dessa reação, em min-1 , é igual a:
Dado: N2 = 28 g/mol
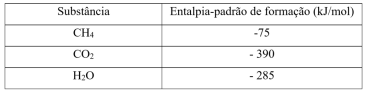
A entalpia-padrão de combustão do metano, em kJ/mol, corresponde a: