Questões de Concurso Público UFES 2015 para Técnico de Laboratório - Química
Foram encontradas 28 questões
A reação de 1 mol de grafita, C(s), com 1 mol de oxigênio gasoso produz 1 mol de dióxido de carbono gasoso. O diagrama abaixo mostra a variação de entalpia para essa reação.
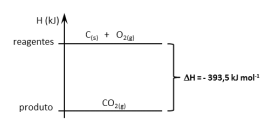
Analise as afirmativas abaixo sobre essa reação.
I. A energia liberada pode ser chamada de entalpia de formação de CO2(g).
II. A energia liberada pode ser chamada de entalpia de combustão de grafita.
III. É uma reação endotérmica.
IV. Para queimar 1 mol de C(s), é necessário fornecer 393,5 kJ para o sistema.
Está(ão) CORRETA(S):
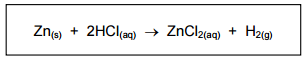
Na reação de zinco metálico (Zn(s)) com ácido clorídrico (HCl(aq)), há formação de cloreto de
zinco (ZnCl2(aq)) e gás hidrogênio (H2(g)), conforme a seguinte equação:
Nessa reação, o HCl é consumido e a tabela a seguir mostra a sua concentração em função do tempo.
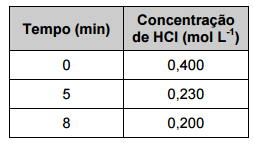
A alternativa que apresenta o valor correto da velocidade média da reação (mol L-1 min-1
) no intervalo de 5 a
8 minutos é
O volume, em litros (L), de uma solução de H2SO4 1,0 mol L-1 que reage com 0,5 mol de NaOH é:
Analise as reações abaixo.
I. SO2 + H2O2 -› H2SO4
II. SO2 + H2O -› H2SO3
III. SO2 + NH4OH -› NH4HSO3
Das reações, ocorre o fenômeno de oxirredução em
A tabela a seguir fornece os valores de pH ou pOH de soluções.

Arespeito da concentração molar de íons hidrogênio [H+] presente nas soluções, é CORRETO afirmar:
Cr2O72-(aq) + 6Fe2+(aq) + 14H+(aq) -› 2Cr3+(aq) + 6Fe3+(aq) + 7H2O(l)
Considerando a estequiometria dessa reação, a porcentagem em massa de Fe na amostra analisada é, aproximadamente, igual a

Com base nos dados tabelados, são considerados “eletrodos de sacrifício” adequados as barras de
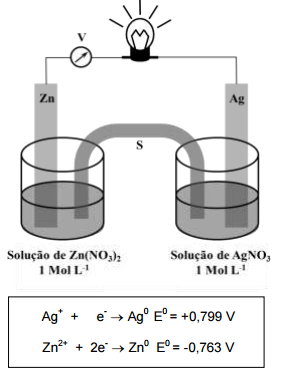
Considerando a célula eletroquímica e os potenciais-padrão de redução acima representados, é CORRETO afirmar:
SO2(g) + ½O2(g) ⇋ SO3(g)
A expressão da constante de equilíbrio KC, com base na lei de ação das massas, para esta reação é
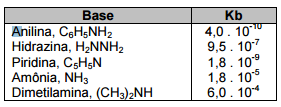
Analisando esses valores, é CORRETO afirmar:
I. A absorbância (A) de uma solução está relacionada com a transmitância de forma logarítmica, A=-log T. II. A absorbância é diretamente proporcional à concentração de uma espécie absorvente (c) e ao caminho óptico (b) do meio absorvente, A=εbc III. A constante de proporcionalidade chamada absortividade molar, à qual é dado o símbolo especial ε, é independente da natureza da espécie analisada. IV. Se a concentração é expressa em mols por litro e o caminho óptico em centímetros, então o coeficiente de absortividade molar possui as unidades de L mol-1cm-1.
Estão corretas APENAS as afirmativas