Questões de Concurso Público UFES 2015 para Técnico de Laboratório - Química
Foram encontradas 5 questões
A reação de 1 mol de grafita, C(s), com 1 mol de oxigênio gasoso produz 1 mol de dióxido de carbono gasoso. O diagrama abaixo mostra a variação de entalpia para essa reação.
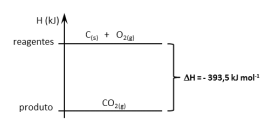
Analise as afirmativas abaixo sobre essa reação.
I. A energia liberada pode ser chamada de entalpia de formação de CO2(g).
II. A energia liberada pode ser chamada de entalpia de combustão de grafita.
III. É uma reação endotérmica.
IV. Para queimar 1 mol de C(s), é necessário fornecer 393,5 kJ para o sistema.
Está(ão) CORRETA(S):
Analise as reações abaixo.
I. SO2 + H2O2 -› H2SO4
II. SO2 + H2O -› H2SO3
III. SO2 + NH4OH -› NH4HSO3
Das reações, ocorre o fenômeno de oxirredução em

Com base nos dados tabelados, são considerados “eletrodos de sacrifício” adequados as barras de
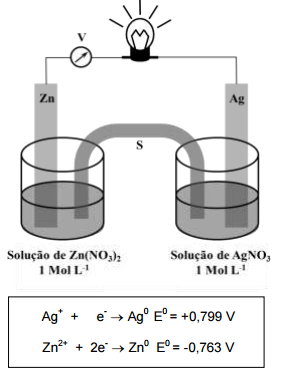
Considerando a célula eletroquímica e os potenciais-padrão de redução acima representados, é CORRETO afirmar:
I. O eletrodo adequado para medidas de pH mede o potencial que se desenvolve através de uma fina membrana de vidro que separa duas soluções com diferentes concentrações do íon hidrogênio. II. A potenciometria é uma técnica eletroanalítica em que se obtêm medidas de potencial geradas por espécies químicas em um meio, sem a necessidade da utilização de um eletrodo de referência. III. A medida do potencial de um eletrodo indicador pode ser utilizada para determinar o ponto de equivalência de uma titulação.
É CORRETO