Questões de Concurso Público UFES 2015 para Técnico de Laboratório - Química
Foram encontradas 10 questões
Cr2O72-(aq) + 6Fe2+(aq) + 14H+(aq) -› 2Cr3+(aq) + 6Fe3+(aq) + 7H2O(l)
Considerando a estequiometria dessa reação, a porcentagem em massa de Fe na amostra analisada é, aproximadamente, igual a
I. O eletrodo adequado para medidas de pH mede o potencial que se desenvolve através de uma fina membrana de vidro que separa duas soluções com diferentes concentrações do íon hidrogênio. II. A potenciometria é uma técnica eletroanalítica em que se obtêm medidas de potencial geradas por espécies químicas em um meio, sem a necessidade da utilização de um eletrodo de referência. III. A medida do potencial de um eletrodo indicador pode ser utilizada para determinar o ponto de equivalência de uma titulação.
É CORRETO

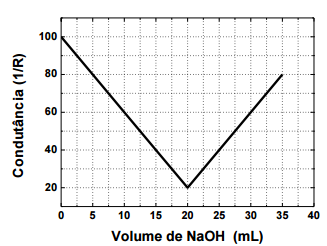
Considerando as medidas de condutância que poderiam ser obtidas para essas soluções, é CORRETO afirmar: