Questões de Concurso Público UFSM 2022 para Técnico de Laboratório - Química
Foram encontradas 5 questões
( ) O eletrodo combinado possui dois eletrodos de referência (Ag/AgCl) que medem a diferença de potencial elétrico por meio da membrana de vidro.
( ) O eletrodo combinado possui um bulbo de vidro com um anel externo de prata metálica (Ag) sensível a íons H+.
( ) O termo eletrodo de vidro combinado é sinônimo de eletrodo de vidro, tendo a mesma estrutura e funcionamento.
( ) As principais interferências para esse tipo de eletrodo são os íons metálicos alcalinos, como o Na+, Li+ e K+.
A sequência correta é
O ácido fosfórico é um reagente amplamente utilizado nas indústrias alimentícias, têxtil e metalúrgica. Na fabricação de fertilizantes, o H3PO4 também é frequentemente empregado na produção de superfosfatos. Em laboratórios de análises químicas, o H3PO4 é frequentemente utilizado para o preparo de soluções aquosas destinadas à realização de um grande número de procedimentos. Esse ácido se dissocia em água de acordo com as seguintes reações de hidrólise:
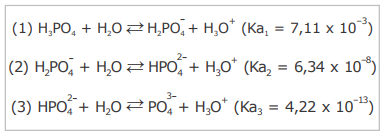
A partir das reações demonstradas acima, considere as seguintes afirmativas.
I - A partir da dissociação do H3PO4, três bases conjugadas são formadas na solução em equilíbrio químico.
II - A etapa (3) de dissociação libera a maior concentração de íons hidrônio (H3O+) na solução em equilíbrio químico.
III - A concentração do ânion 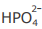 é maior que a concentração do ânion
é maior que a concentração do ânion 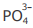 na solução em equilíbrio 4
químico.
na solução em equilíbrio 4
químico.
IV - A concentração do ânion 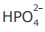 é maior que a concentração do ânion
é maior que a concentração do ânion 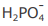 na solução em equilíbrio químico.
na solução em equilíbrio químico.
Estão corretas
Resíduos de metais pesados gerados em laboratório químico podem ser tratados por reação de precipitação com carbonato, geralmente na forma de calcário. O sólido obtido é filtrado em papel e armazenado, sendo que o líquido filtrado é neutralizado antes do descarte. Para a separação de resíduos dos íons metálicos Pb2+ , Cd2+ e Cu2+, a precipitação ocorre de acordo com as seguintes reações:

Em relação às reações de precipitação e seus produtos de solubilidade (Kps), considere as afirmativas a seguir.
I - Cu2+ é o íon mais insolúvel da mistura na precipitação com íon 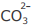
II - Pb2+ é o íon mais solúvel da mistura na precipitação com íon 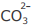
III - Cd2+ é mais insolúvel do que Cu2+ e Pb2+ na
precipitação com íon 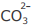
Está(ão) correta(s)
O cloreto de prata (AgCl) é um sal pouco solúvel em água pura, com um produto de solubilidade (Kps) igual a 1,8x10-10. Quando em contato com a água, apresenta uma baixa concentração de íons Ag+(1,34x10-5 mol/L) e íons Cl- (1,34x10-5 mol/L) no equilíbrio químico em solução devido à reação
AgCl(s) ⇄ Ag+ (aq) + Cl- (aq)
Em qual das soluções a seguir o sal AgCl será mais
insolúvel, quando comparado com a água pura?