Questões de Concurso Público UFTM 2016 para Técnico de laboratório - Química
Foram encontradas 4 questões
Cavernas próximas a regiões com solo rico em calcário podem formar estalactites com o passar dos anos. Sua formação pode ser representada pela equação:
CaCO3 (s) + CO2(g) + H2O (l) ⇌ Ca2+ (aq) + 2 HCO3 - (aq)
Dentre as seguintes condições:
I. Evaporação constante da água;
II. Corrente de ar frio e úmido;
III. Elevação da temperatura no interior da caverna;
IV. Visitas frequentes de grandes grupos de pessoas.
Quais favorecem a formação de estalactites?
Acerca das teorias ácido-base e tampão são feitas as seguintes afirmações:
I. Segundo a teoria de Arrhenius ácidos e bases são classificados segundo sua capacidade de doar e receber prótons.
II. Quanto maior o valor da constante de ionização de uma base, maior será o valor do pH da solução.
III. Para uma solução de amônia que apresenta concentração dos íons OH- igual a 10-3 mol L-1, o pH é igual a 3.
IV. Um sistema tampão pode ser formado por um ácido forte e sua base conjugada.
V. Dobrando a concentração de ácido e sua base conjugada, que formam a solução tampão, o pH permanece constante, porém o poder tamponante aumenta.
É CORRETO o que se afirma em:
Íons Ba2+(aq) são altamente tóxicos e suas soluções não podem ser descartadas na rede de esgoto. Esses íons devem, portanto, ser removidos de misturas que se pretende descartar, o que pode ser feito através de reações de precipitação. Para a remoção de íons Ba2+(aq) de 1,0 L de resíduo de concentração 0,01 mol L -1 foram propostos os seguintes procedimentos:
I. Adição de 0,1 L de solução de Na2CO3 0,1 mol L-1
II. Adição de 0,1 L de solução de Na2SO4 0,1 mol L-1
III. Adição de 0,1 L de solução de Na3PO4 0,01 mol L-1
IV. Adição de 0,1 L de solução de NaOH, 0,01 mol L-1
Dado: Constante do produto de solubilidade dos compostos de bário (Ks)
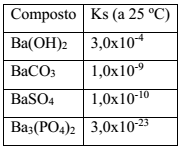
O procedimento que resulta na produção de um material mais adequado ao descarte é: