Questões de Concurso
Sobre química
Foram encontradas 13.691 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Nessa eletrólise, a substância simples formada no catodo é
A geometria molecular da fosfina é nomeada
A fórmula molecular desse ácido é
A fórmula química desse sal é
A massa, em gramas, de soluto a ser empregada no preparo dessa solução corresponde a
Dado massas molares: Ca = 40 g mol-1 Br = 80 g mol-1
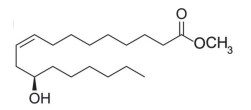
De acordo com as regras de nomenclatura da IUPAC, o nome do ricinoleato de metila é
Em relação à técnica de cromatografia, o termo partição significa
LOD = 3 x (desvio padrão do branco / inclinação da curva de calibração) LOQ = 10 x (desvio padrão do branco / inclinação da curva de calibração)
Considere que um procedimento de validação foi feito para determinar o LOD e o LOQ de um certo método analítico em espectroscopia de absorção atômica. Foram feitas dez medições do branco que, por sua vez, produziram valor médio = 4,24 x 10-3 com desvio padrão = 3,42 x 10-4 . A equação da reta da curva de calibração do método, com os seus respectivos coeficientes angular e linear, foi:
Absorbância = 3,42 x 10-3 conc. (mg L-1 ) + 2,23 x 10-3
O coeficiente de determinação (R2 ) da curva de calibração foi 0,9994. Com base nesses dados, os valores de LOD e de LOQ, em mg L-1 , foram, respectivamente,
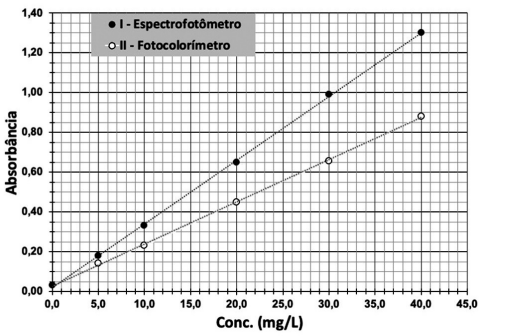
Admita que uma amostra desconhecida do mesmo analito, denominada solução A, foi diluída duas vezes, formando a solução B. A absorbância da solução B foi de 0,60 nas mesmas condições da curva de calibração com maior sensibilidade apresentada na Figura acima.
A concentração do analito na amostra desconhecida antes de diluição (solução A), em mg L-1 , era de
H2 N-CH2 -CH2 -CH2 -CH2 -NH2(aq) + 2 H+ (aq) ⇌ +H3 N-CH2 -CH2 -CH2 -CH2 -NH3 + (aq)
Nesse sistema, verifica-se que o(a)
Baseado no tamanho e no grau de espalhamento de luz incidente, calculou-se em 1 × 10-5 mol L-1 a concentração de AgNP na dispersão. A partir do tamanho médio, determinou-se que haveria 500 átomos de Ag por nanopartícula.
Considerando-se esses dados, verifica-se que a massa de prata, em mg, presente em 1 mL de dispersão é
Dado 1 mol = 6 x 1023 unidades M (Ag) = 108 g mol-1
NaHCO3(s) + H3 O+ (aq) → Na+ (aq) + 2H2 O(l) + CO2(g)
Considerando-se a proporção estequiométrica e o rendimento completo de reação, a massa de bicarbonato de sódio necessária para neutralizar 20,0 L de solução aquosa, cujo pH medido foi 2, é
A concentração, em mol L-1 , do hidróxido na solução é
Dado M(NaOH) = 40 g mol-1
A concentração do princípio ativo, em g L-1 , dessa solução final é, aproximadamente,
CaCO3(s) → CaO(s) + CO2(g); ΔH0 = +179 kJ
Considerando-se o comportamento ideal do gás e o rendimento máximo da reação, a energia necessária, em MJ, para produzir 36 m3 de CO2 , medido nas condições normais de temperatura e pressão (CNTP) é, aproximadamente,
Dado R × T = 24,4 atm L mol-1 M = 106
S(s) + O2(g) → SO2(g)
A reação do enxofre foi completa, e a massa da matéria prima era 80,0 kg.
A partir dessa informação, a percentagem, em massa, de enxofre elementar na matéria prima é, aproximadamente,
Dado R = 0,082 atm L mol-1 K-1
Considere o sistema de equações a seguir, que envolvem reações de hidrocarbonetos.
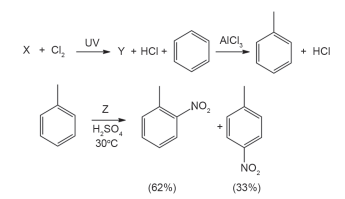
As substâncias X, Y e Z são, respectivamente
O PTFE é um fluoropolímero sintético com alta massa molecular, cujo precursor monomérico é o tetrafluoretileno (TFE). O PTFE é conhecido por ser antiaderente, ter alta estabilidade térmica e baixa reatividade química.
Das estruturas a seguir, a que representa a unidade de
repetição do PTFE é a