Questões de Concurso
Sobre química
Foram encontradas 13.691 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Considere a estrutura química da testosterona.
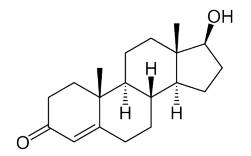
A massa molar para a estrutura química fornecida na imagem será, aproximadamente, de:
Dados de massas molares: C = 12 g/mol, H = 1 g/mol e O = 16 g/mol.
C2H6O + O2 → CO2 + H2O
Para a reação descrita, 3,0 g de C2H6O foi adicionado a um ambiente contendo 100,0 g de oxigênio. A massa (g) de CO2 produzida será, aproximadamente, de:
Dados de massas molares: C = 12 g/mol, H = 1 g/mol e O = 16 g/mol.
I. SO3 II. Al2O3 III. NO2 IV. Fe3O4 V. Na2O2 VI. Na2O
Sobre as propriedades dessas substâncias químicas, assinale a alternativa correta.
Dada a equação química
Fe + H2SO4 → Fe2(SO4)3 + H2
a soma de todos os menores coeficientes estequiométricos da
equação balanceada pelo método das tentativas é igual a
Compete ao nível representacional
A aula experimental em laboratório de química configura uma atividade cujo objetivo é exercitar a observação e evidenciar a transformação química, seja pela mudança de coloração, formação de precipitados ou liberação de gases.
O trecho foi extraído de uma apostila de aulas experimentais de química. Nesse experimento, o aluno deverá perceber a formação de um precipitado amarelo.
Com o desenvolvimento dessa atividade, o aluno poderá perceber e concluir sobre a possível ocorrência de uma reação
O texto defende a inclusão de história de ciências no currículo em ação.
As opções a seguir apresentam vantagens para o uso da história das ciências, à exceção de uma. Assinale-a.
STRATHERN, Paul. O Sonho de Mendeleiev - A verdadeira história da Química. 2002. Zahar.
Assinale a opção que apresenta corretamente a Lei de Dalton.
“Além do ácido sulfúrico, o Falso Geber descreveu também como fazer ácido nítrico forte.”
STRATHERN, Paul. O Sonho de Mendeleiev - A verdadeira história da Química. 2002. Zahar.
Os métodos usados por alquimistas, ainda que rudimentares, permitiram o isolamento de ácidos acético, lático, sulfúrico e nítrico. O último, conhecido na época como água forte, se destacava pela “assombrosa capacidade de dissolver quase tudo, exceto ouro”.
[Dados: Potenciais de Redução Padrão:
2H+ + 2e- → H2 E0 = 0,00 V NO3- + 4H+ + 3e- → NO + 2H2O E0 = 0,96 V NO3- + 2H+ + e- → NO2 + H2O E0 = 0,80 V Cu2+ + 2e → Cu E0 = 0,34 V]
Tomando o cobre como exemplo, a capacidade do ácido nítrico dissolver esse metal deve ser, à luz do conhecimento atual, justificada pela
A sequência de reações que ocorrem no momento da coleta é:
• Mn2+ + 2 OH- → Mn(OH)2 • 2Mn(OH)2 + O2 → 2 MnO(OH)2
Já no laboratório, a solução é acidificada e o precipitado édissolvido:
• MnO(OH)2 + 4 H+ → Mn4+ + 3 H2O • Mn4+ + 2 I- → Mn2+ + I2
O iodo formado é titulado com tiossulfato permitindo adeterminação do O2.
Nesta sequência de reações, 1 mol de I2titulado equivale a
MACHADO, A.H. Aula de Química: discurso e conhecimento. Ed. UNIJUÍ, Ijuí, 3ª ed., 2014
Neste texto, Machado critica o uso dos níveis de conhecimento que podem ser usados no ensino de Química.
Para atingir um balanço mais adequado entre os níveis, o professor poderia adotar em sua sala de aula
Embora os fosfatos não apresentem toxicidade elevada, são excelentes nutrientes e favorecem a proliferação excessiva de algas e cianobactérias. Esse fenômeno é chamado eutrofização.
A esse respeito, assinale a afirmativa incorreta.
Essa diferença de valores pode ser explicada pelas diferenças de estrutura molecular dos dois compostos e de forças intermoleculares que atuam em cada líquido.
A esse respeito, assinale V para a afirmativa verdadeira e F para a falsa.
( ) ligações dipolo-induzido que se manifestam entre moléculas de 1-propanol são responsáveis pelo seu alto ponto de ebulição. ( ) ligações de hidrogênio mantém unidas as moléculas de metoxietano e são responsáveis pelo baixo ponto de ebulição. ( ) o ponto de ebulição do 1-propanol é maior devido à ação de forças de van der Waals.
As afirmativas são, respectivamente,
SO2Cl2 (g) → SO2 (g) + Cl2 (g)
A reação é conduzida em reator fechado, de 2,5L, contendo inicialmente 0,05 mol de SO2Cl2, a 600K. Dessa forma, a pressão inicial é de 1atm, totalmente devido ao reagente.
A reação segue cinética de primeira ordem, na qual o tempo de meia-vida, a 600K, é igual a 4,1h.
O tempo no qual a pressão total do sistema terá atingido um aumento de 87,5% é
Nesta temperatura, a constante de equilíbrio, Kc, vale 4.
O número de mols de acetato de etila presente no meio reacional após o equilíbrio ter sido atingido será, aproximadamente, igual a
0,700g de amostra foi digerido e alcalinizado com excesso de solução de hidróxido de sódio. Após destilação, a amônia foi coletada em 25,00mL de solução de ácido sulfúrico 0,0750mol L–1. A titulação do excesso do ácido requereu 5,00mL de solução de hidróxido de sódio 0,1250 mol L–1.
[Dados: Massa molar do nitrogênio = 14 g mol–1.]
O teor de nitrogênio na amostra é de