Questões de Concurso
Sobre química
Foram encontradas 13.691 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Recomendou-se, a esses estudantes:
O técnico do laboratório foi o responsável por esse preparo do fluxo laminar, cuja atividade realizada corretamente foi:
1. Carga elétrica 2. Tamanho 3. Densidade 4. Solubilidade 5. Afinidade
( ) Uma membrana semipermeável, contendo a mistura de proteínas, é introduzida em uma solução aquosa hipotônica e mantida sob agitação até o equilíbrio osmótico. ( ) O sobrenadante proteico, contendo proteínas solúveis, é centrifugado várias vezes com aumento progressivo de tempo e velocidade do processo. ( ) Durante o preparo da amostra, as proteínas são carregadas negativamente pela interação com um detergente aniônico, e migram por um gel polimérico impulsionadas por uma diferença de potencial. ( ) A fase estacionária é constituída por um ligante específico, formando um complexo ligante-proteínas, cujas interações são posteriormente rompidas, adicionando-se excesso de ligante ou pela alteração do pH do meio. ( ) As proteínas migram por um gel polimérico contendo um gradiente de pH. ( ) É possível observar um comportamento de salting in ou salting out da proteína diante de diferentes concentrações de sal em um meio aquoso.
Assinale a sequência correta.
I- A primeira etapa da PCR consiste na desnaturação do DNA pela elevação de temperatura, que mimetiza a ação da enzima helicase, induzido o rompimento das interações por pontes de hidrogênio entre as fitas poliméricas.
II- Sem a adição de pequenas sequências de RNA, denominadas primers, que servem como iniciadores para a ação da enzima polimerase, a amplificação do material genético não ocorre, mesmo estando o DNA extraído em perfeitas condições biológicas.
III- Na etapa de anelamento, ocorre o resfriamento do sistema, realizado com o objetivo de possibilitar a ligação dos primers ou iniciadores às fitas simples de ácidos nucleicos, que ocorre por meio de pontes de hidrogênio.
IV- Os primers utilizados na PCR devem ser extraídos de bactérias termófilas, pois precisam resistir a elevadas temperaturas durante o ensaio.
V- Na PCR em tempo real, o anelamento dos primers permite a detecção de sequências específicas de DNA, uma vez que esses fragmentos podem ser ligados a moléculas fluorescentes.
VI- A RT-PCR permite a amplificação de sequências de RNA em uma amostra biológica, porém é dependente da presença de uma RNA polimerase denominada transcriptase reversa.
Estão corretas as afirmativas
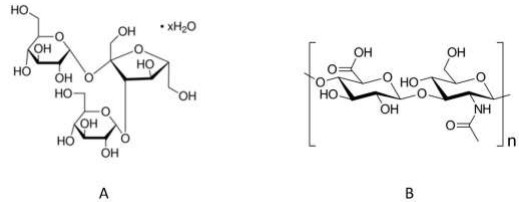
Sobre os carboidratos representados, marque a afirmativa correta.
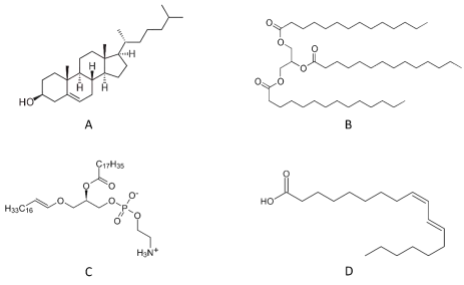
As estruturas A, B, C e D representam, respectivamente:
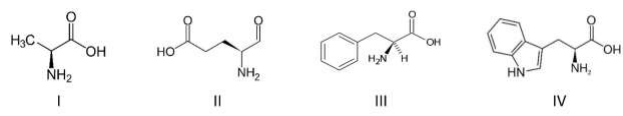
Assinale a afirmativa correta.
Assinale a afirmativa correta.
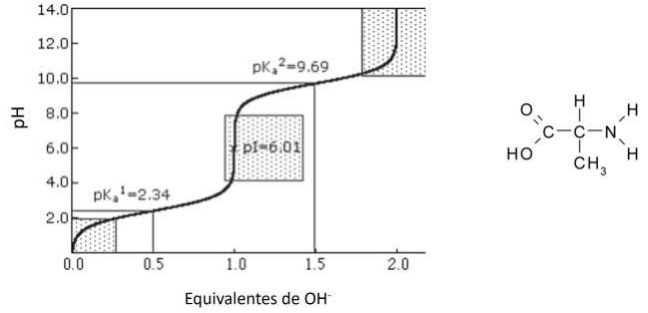
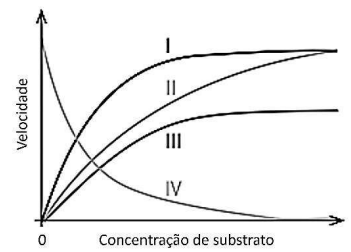
Com base no gráfico e na estrutura, marque a afirmativa INCORRETA.

Considere MM (massa molecular) de C = 12 g/mol, O = 16 g/mol, H = 1g/mol e Na = 23 g/mol.

M (molaridade) = mol/L é uma unidade de concentração. Considere pKa = 3,8.
Massas Molares em g/mol: C=12,011; O=16,000; Ca=40,01; Dados: R = 0,082 L.atm/mol.K; T(k) = t(°C) + 273
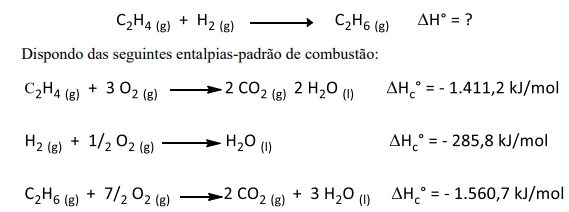
O ΔH° para a reação em questão, em kJ/mol, será igual a:
[Pt(Cl)(dien)]+ (aq) + I- (aq) → [Pt(I)(dien)]+ (aq) + Cl- (aq)
sendo: Dien = dietilenodiamina.
A respeito da troca de ligante Cl- por I- , é correto afirmar que a lei de velocidade dessa reação será de
( ) Dois termos podem ser empregados para medir eficiência da coluna cromatográfica: Altura do prato teórico (H) e número de pratos teóricos (N), onde N = L/H, onde L = comprimento do empacotamento da coluna (cm). ( ) A eficiência da coluna cromatográfica aumenta à medida que N é menor conforme H aumenta. ( ) A resolução de uma coluna cromatográfica é uma medida qualitativa de sua habilidade em separar dois analitos A e B. ( ) Experimentalmente, pode-se calcular a eficiência da coluna pela equação N = 16 (tR/W)2 , onde tR é o tempo de retenção de um pico, e pela sua base W (em unidades de tempo).
Assinale a sequência correta.