Questões de Concurso
Sobre química
Foram encontradas 13.691 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Observe as estruturas dos ácidos abaixo:
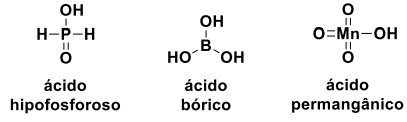
Sobre esses ácidos, analise as seguintes afirmações:
1. O ácido hipofosforoso possui três hidrogênios ionizáveis.
2. No ácido permangânico, o número de oxidação do Mn é +7.
3. O ácido bórico possui hibridação sp2 e geometria trigonal plana.
4. Devido à presença do metal, o ácido permangânico é o mais fraco.
Estão corretas, apenas:
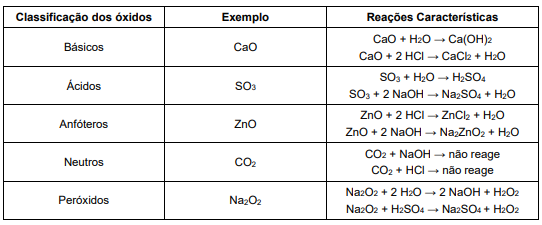
Ao observar a tabela, o professor precisou explicar ao estudante que um exemplo estava errado e não correspondia à classificação sugerida. A categoria cujo exemplo está incorreto é a dos óxidos:
Usado para a limpeza de peças e ferramentas, o ácido muriático é uma solução impura de ácido clorídrico e pode ser encontrado em lojas de materiais de construção. Com o objetivo de determinar a concentração de um lote desse produto em termos de porcentagem de HCl (m/V), um químico reagiu uma alíquota de 50mL do ácido muriático comercial com carbonato de cálcio em excesso, conforme a reação:
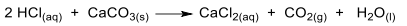
Nesse experimento, o volume coletado de CO2 foi 6,15L a 27oC e 1 atm. Qual é a porcentagem de HCl (m/V) na amostra de ácido muriático?
Massas molares (g/mol): H = 1; C = 12; O = 16; Cl = 35,5; Ca = 40
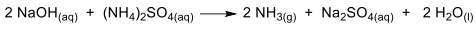
Considere que, em uma indústria química, são colocados em um reator 60kg de NaOH, 66kg de (NH4)2SO4 e água suficiente para solubilizar os reagentes. A reação ocorre até que um dos reagentes seja completamente consumido. Considerando as CNTP, o volume obtido de NH3(g) é:
Massas molares (g/mol): H = 1; O = 16; N = 14; Na = 23; S = 32

Considerando que essa reação tem um rendimento de 90%, calcule a massa de alumínio necessária para a produção de 11,2 kg de ferro para solda.
Massas molares (g/mol): O = 16; Al = 27; Fe = 56.

A reação não está balanceada. Faça o balanceamento, considerando os menores inteiros como coeficientes reacionais. A soma desses coeficientes é igual a:
Dados: densidade Hg(l) = 13,6 kg/dm3 ; massa molar Hg = 200 g/mol; considere o número de Avogadro = 6 x 1023
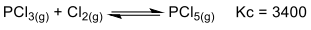
Considere que a reação acima está em equilíbrio e que as concentrações de PCl3 e Cl2 são 1,0 x 10-3 molL-1 e 1,0 x 10-2 molL-1 , respectivamente. Nessas condições, a pressão de PCl5 no equilíbrio será:
Dado: Kps (PbCl2) = 1,6 x 10-5
Considere os dados da tabela abaixo:

De acordo com os dados acima, o ânion que atua como base mais forte é:
Dados: log 2 = 0,3 e log 3 = 0,48
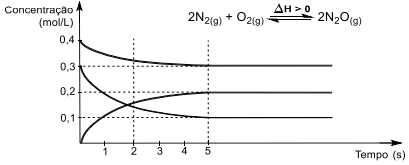
Sobre esse sistema reacional, é correto afirmar que:
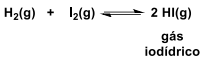
Considere um reator de 10L em que inicialmente são colocados 0,9 mol de H2(g) e 0,9 mol de I2(g) na temperatura T. Quando o equilíbrio for atingido, a concentração molar de HI(g) no equilíbrio será de:
Dado: log 3 = 0,48
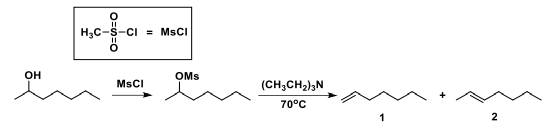
Sobre a etapa de eliminação, é correto afirmar que:
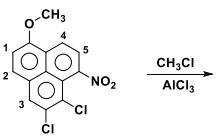
Na alquilação proposta acima, o grupo metil entrará preferencialmente na posição assinalada com:
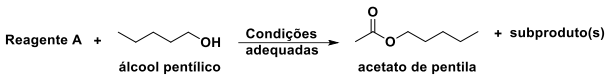
Considerando o esquema da reação acima, qual substância NÃO poderia ser utilizada como o “Reagente A”?