Questões de Concurso
Sobre química
Foram encontradas 13.691 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
I. A presença de bandas espectrais na região de 3500cm-1 pode indicar que a molécula possui grupamento OH. II. A presença de carbonilas pode ser verificada pela presença de fortes bandas na região de 2800cm-1. III. O uso desta técnica possibilita a dedução da fórmula estrutural completa das substâncias químicas já que indica os grupos funcionais presentes. IV. O uso dos espectros de infravermelho poderá contribuir em estudos de ligações de hidrogênio formadas por grupamentos NH e OH.
São INCORRETAS apenas as afirmativas:
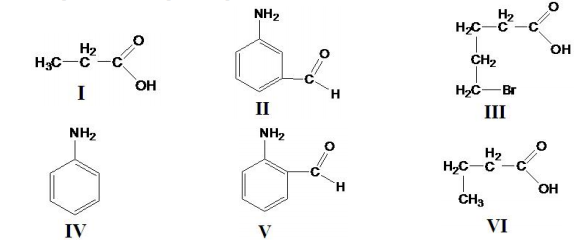
A questão é baseada na seqüência de reações abaixo:

A questão é baseada na seqüência de reações abaixo:

4Aℓ(s) + 3O2(g) → 2Aℓ2O3(s)
I. É utilizada na determinação da massa molecular de substâncias químicas contendo poucos átomos. II. O pico do íon molecular corresponde à massa do fragmento mais estável da molécula. III. Na técnica do impacto de elétrons, o equipamento bombardeia moléculas da amostra na fase de vapor com um feixe de elétrons de alta energia e registra o resultado como um gráfico contínuo cujo valor máximo no eixo y corresponde à massa molecular da substância analisada. IV. Os picos de massas podem ser produzidos por rearranjos ocorridos com fragmentos menos estáveis da amostra.
Está(ão) INCORRETA(S) apenas a(s) afirmativa(s):
Frasco 1: Formação de um precipitado branco com a adição de solução de cloreto de bário, sendo este, precipitado insolúvel em solução diluída de hidróxido de amônio, e também, insolúvel em solução diluída de ácido clorídrico. Frasco 2: Formação de um precipitado branco com a adição de solução de cloreto de sódio, sendo este precipitado solúvel em solução diluída de hidróxido de amônio. Frasco 3: Formação de precipitado amarelo com a adição de solução diluída de cromato de potássio. Frasco 4: Efervescência em contato com solução diluída de ácido clorídrico.
A partir dos resultados dos testes realizados pode-se inferir que o conteúdo de cada frasco é, respectivamente:
I. A Teoria Atômica de Dalton trouxe o átomo do campo filosófico para uma perspectiva científica. II. A descoberta dos raios catódicos foi fundamental para a conclusão de que a matéria é formada por partículas eletricamente carregadas. III. A estabilidade do modelo atômico de Rutherford poderia ser explicada pelas leis da Física Clássica, mas não pela Física de Planck-Einstein. IV. O efeito fotoelétrico observado por Einstein corroborou a idéia da dualidade onda-partícula dos elétrons.
Estão corretas apenas as afirmativas:
ICℓ(g) + H2(g) → HI(g) + HCℓ(g) (etapa lenta) ICℓ(g) + HI(g) → I2(g) + HCℓ(g) (etapa rápida)
Tendo em vista os referidos dados e sabendo-se que as concentrações molares das substâncias envolvidas estão representadas entre colchetes, pode-se afirmar corretamente que a equação de velocidade desta reação deverá ser representada por:
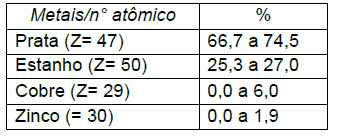
Roberto R. da Silva, et al. A química e a conservação dos dentes, Quím. Nov. na Esc.; N° 13, maio 2001.
Em relação aos metais presentes nas ligas e a tabela periódica é CORRETO a firmar:
Ca5(PO4 )3OH(s) 5Ca2+ (aq) + 3 PO4 3– (aq) + OH– (aq)
Esse processo é normal e ocorre naturalmente. O processo inverso, a mineralização, também é normal.
Roberto R. da Silva, et al. A química e a conservação dos dentes, Quím. Nov. na Esc.; N° 13, maio 2001.
Sobre a reversibilidade do equilíbrio, representado pela equação, através dos processos direto e inverso. Podemos concluir que esse equilíbrio é:
Em contato com a pele, o cloro causa irritações e queimaduras químicas com ulceração e descascamento da pele, o que resulta em dermatites. O contato desse elemento com os olhos pode causar inflamação da conjuntiva, opacidade da córnea e atrofia da íris.
O local deve ser higienizado e esterilizado antes do início da pesagem. O responsável pelo procedimento deve obrigatoriamente realizar a assepsia das mãos e antebraços e usar uniforme de uso exclusivo na área analítica. A pesagem deve ser realizada o mais rápido possível para que a umidade não interfira na massa final da amostra.
Nessa situação hipotética, para preparar 1,5 mL de uma solução diluída a 10 μg/L diretamente a partir da solução-padrão estoque, é necessário tomar
10 μL da solução concentrada.
De acordo com o procedimento adotado na situação hipotética descrita, julgue os itens que se seguem.
Caso o emprego de ácido clorídrico diluído resulte na formação de um precipitado, então a amostra pode ser constituída de metais do grupo I. Nesse caso, o precipitado deve ser separado por filtração e examinado com relação a esse grupo. Alternativamente, a amostra original pode ser diretamente dissolvida em ácido nítrico concentrado.
De acordo com o procedimento adotado na situação hipotética descrita, julgue os item que se segue.
O passo inicial é a solubilização a frio e depois a quente. Caso a rocha se dissolva na água, deve ser realizado imediatamente o ensaio pulverizado para íons metálicos.
A respeito de análises químicas de campo, julgue o item a seguir.
O método iodométrico utiliza a capacidade do oxigênio de
oxidar o Mn2+ sob condições alcalinas. Uma vez oxidado, o
manganês torna-se capaz de oxidar o iodeto para I2 em
condições ácidas. Dessa forma, a quantidade de I2 no final da
reação é proporcional ao oxigênio originalmente presente.