Questões da Prova IF-SP - 2011 - IF-SP - Professor - Química I
Foram encontradas 50 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Dados:
Capacidade calorífica da água: 1 cal.g-1 . o C-1 .
Capacidade calorífica da solução neutralizada:1 cal.g-1 . o C-1 .
Densidade da água e de todas as soluções envolvidas: 1g.mL-1 .
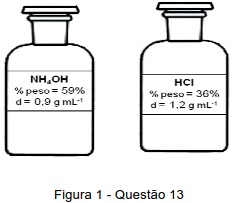
De acordo com as previsões do estudante, para produzir a quantidade de gás hidrogênio desejada ele deverá utilizar 500 mL de uma solução 6 mol L-1 preparada a partir de um dos reagentes acima. Indique a alternativa onde são apresentados, respectivamente, a identidade e o volume do reagente concentrado que o estudante deverá utilizar.
Dados: H = 1 g mol -1 ; N = 14 g mol -1 ; O = 16 g mol -1 ; Cl = 35,5 g mol -1 ; Zn = 65,4 g mol -1 .
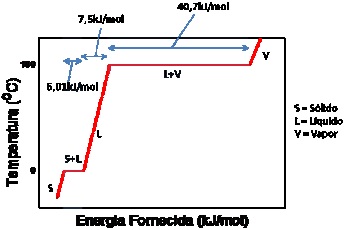
Figura 1 – Questão 12: Curva de aquecimento da água pura. (Adaptado). Fonte: Atkins, P. Jones, L. Chemistry, Molecules, Matter and Change. 4th ed. W. H. Freeman and Company. New York, 1999.
O mínimo de energia necessário para passar 1g de água do estado sólido para o estado vapor é: Dados: H= 1 g mol -1; O = 16 g mol -1
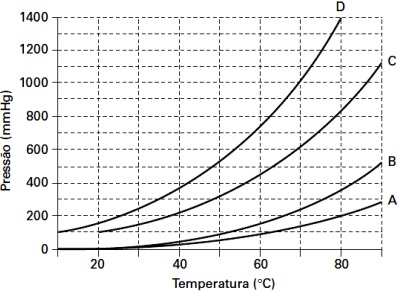
Figura 1 – Questão 11: Variação da pressão de vapor em função da temperatura para quatro diferentes substâncias puras.
Substância Massa Molar g mol-1 CHCl3 (Clorofórmio) 119,5
H2O (água) 18 CH3CH2OH (etanol) 46 CH2(OH)COOH (ácido glicólico) 76
As curvas apresentadas no gráfico foram obtidas em experimentos utilizando as substâncias listadas na Tabela 1. Identifique a alternativa que associa corretamente as curvas do gráfico às suas respectivas substâncias.
As curvas apresentadas no gráfico foram obtidas em experimentos utilizando as substâncias listadas na Tabela 1. Identifique a alternativa que associa corretamente as curvas do gráfico às suas respectivas substâncias.
I3- + 2e- ⇌ 3 I -
Considerando as informações fornecidas acima, qual a quantidade de matéria de I3 - consumida após a passagem de 0,193 A durante 500 s ?
Dado: Constante de Faraday = 96500 C mol -1