Questões de Concurso
Comentadas para covest-copset
Foram encontradas 2.060 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Um laboratório de pesquisa testou alguns compostos antitumorais selecionados quanto à concentração necessária para destruir 50% de uma população de células cancerígenas (IC50). Foram testadas células de leucemia e de melanoma, de acordo com a tabela abaixo:
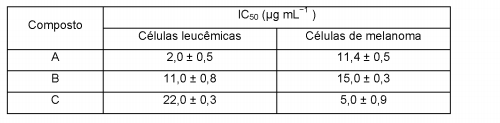
Indique o composto mais eficiente para a destruição de células de melanoma com o respectivo valor de IC50, calculado
em ppm.
Uma solução de permanganato de potássio pode ser titulada com solução de oxalato de sódio em meio ácido, de acordo com a reação não balanceada:
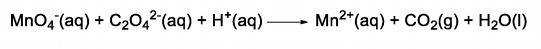
A semirreação de redução está corretamente representada em:
O carbonato de magnésio é um composto salino, branco e que existe como um composto anidro ou hidratado, de acordo com o esquema abaixo:
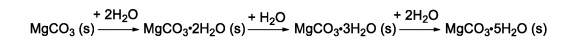
Essa capacidade de “capturar” sucessivas moléculas de água influencia na característica higroscópica do carbonato de
magnésio e permite seu uso como agente secante. Chamado de pó de magnésio, é amplamente utilizado por atletas de
ginástica e levantamento de peso para a absorção do suor das mãos. O tipo de ligação que se forma entre a água e o
carbonato de magnésio é uma interação:
Um dos ligantes mais amplamente utilizados nas titulações de complexação é o EDTA, cuja fórmula estrutural é mostrada abaixo:
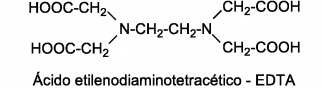
Sobre esse importante reagente, é incorreto afirmar:
Uma titulação entre uma base fraca e um ácido forte apresenta a curva de pH abaixo, onde S é o ponto estequiométrico (também chamado de ponto de equivalência).
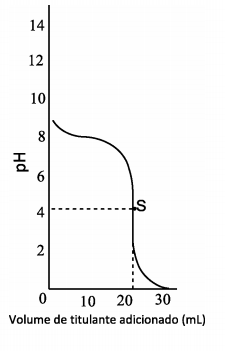
Sabendo que log 2 = 0,3 e considerando as opções apresentadas, o indicador mais eficiente para esta titulação é:
Para determinar a concentração de íons iodeto em 200 mL de uma solução, foi adicionado bromo, a fim de converter iodeto em iodato, de acordo com a reação:

Posteriormente, o íon iodato foi precipitado como iodato de bário, através da adição de íons bário:
Sabendo que se obteve, ao final do processo, 0,974 g de iodato de bário, calcule a concentração de iodeto na solução em
g/L. Massas molares (g/mol): O = 16; I = 127; Ba = 137.
Considere os átomos neutros X e Y, cujas distribuições eletrônicas são mostradas abaixo:
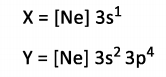
O composto formado por esses dois elementos é:
Considere os ácidos abaixo

Um estudante prepara soluções aquosas desses ácidos com a mesma concentração molar. Sobre esses ácidos e as
espécies presentes nas soluções, é correto afirmar que:
Considere a reação ácido-base de Lewis entre gás clorídrico e amônia:
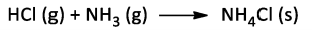
Considerando 100% de rendimento, calcule o volume mínimo da mistura equimolar dos reagentes, a 27ºC e 1 atm, de
modo que seja possível a obtenção de 10,7g do produto. Massas molares (g/mol): H = 1; N = 14; Cl = 35,5.
Quando, no estado gasoso, um átomo neutro de cloro absorve energia e perde um elétron, ocorre a formação de íon Cl+(g) de acordo com a equação abaixo:

A energia absorvida é definida como: