Questões de Concurso
Para comvest ufam
Foram encontradas 2.084 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
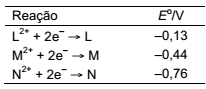
As pilhas eletroquímicas são dispositivos que produzem energia elétrica a partir de reações espontâneas de oxirredução que é medida pelo potencial de redução. De acordo com os potenciais de redução na tabela a seguir, assinale a afirmação CORRETA nas condições normais?
Nos Estados Unidos (USA), os postos de combustíveis automotivos geralmente disponibilizam gás (CH4, metano), metanol (CH3OH, álcool metílico) e gasolina (C8H18, fórmula química aproximada), respectivamente. A reação de combustão completa e energia liberada na forma de calor desses combustíveis são apresentadas a seguir:
I. CH4(g) + O2(g) → CO2(g) + H2O(g)
ΔHm = –960 kJ mol–1
II. CH3OH(ℓ) + 3/2 O2(g) → CO2(g) + 2H2O(g) ΔHm = – 670 kJ mol-1
III. C8H18(ℓ) + 25/2 O2(g) → 8CO2(g) + 9H2O(g) ΔHm = – 5700 kJ mol-1
Com base nos dados estabeleça a ordem
decrescente dos combustíveis em relação a energia
liberada com uma mesma quantidade em massa.
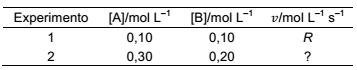
Existem muitos motivos para estudar a velocidade de uma reação, do ponto de vista prático, o conhecimento das velocidades de reações é útil na concepção de medicamentos, no controle da poluição e no processamento de alimentos, bem como nas aplicações de setores produtivos em geral. Então para exemplificar, considere que a velocidade de uma reação entre os compostos A e B segue a lei de velocidade, v = k [A] 2 [B] . Com base nos dados da tabela abaixo, determine a velocidade do Experimento 2 observada a mesma temperatura do Experimento 1.
A palavra cinética, no caso da Química, refere-se à velocidade de uma reação, isto é, à variação da concentração de desaparecimento de um reagente ou de surgimento de um produto com o tempo. Para exemplificar, considere que a 280 °C, o dióxido de nitrogênio se decompõe no óxido nítrico e oxigênio:
2NO2(g) → 2NO(g) + O2(g)
E que em um experimento, a concentração de NO2 diminui de 0,010 mol L–1 a 0,005 mol L–1 no período de 100 s. Qual é a velocidade média de desaparecimento de NO2?

Assinale a alternativa correta:
Devido à grande emissão de gases lançados na atmosfera, nas regiões mais populosas é evidente a ocorrência da chuva ácida. Na sua precipitação, um dos ácidos responsáveis pela acidez é o sulfúrico. Um equilíbrio envolvido na formação desse ácido na água da chuva está representado pela equação:
2SO2(g) + O2(g) ⇌ 2SO3(g)
Considere que são colocados 6 mol de SO2, 5 mol de O2 e 4 mol de SO3 num recipiente fechado de 5,0 L para reagirem até o sistema atingir o equilíbrio a dada temperatura. A variação do número de mol dos gases participantes está registrada no gráfico.
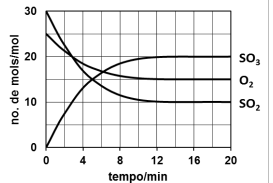
Nestas condições, a constante de equilíbrio, KC, é
igual a:
Assinale a alternativa que correlaciona, corretamente, as colunas.
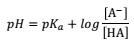
em que, o HA é o ácido e A– é a base conjugada.
Com base no exposto, identifique as afirmativas verdadeiras.
I. O pH da solução será igual ao pKa se a [A– ] for igual a [HA]
II. O pH tende a aumentar se a concentração a [A– ] for maior que [HA]
III. O pH tende a diminuir se a concentração a [A– ] for maior que [HA]
IV.O pH tende a aumentar se a concentração a [A– ] for menor que [HA]
V. O pH tende a diminuir se a concentração a [A– ] for menor que [HA]
Assinale a alternativa correta:
Os indicadores são substâncias naturais ou sintéticas que apresentam cores bem distintas em ácido e básico. Para uma série de indicadores, as seguintes cores e faixa de pH sobre a qual a mudança de cor ocorre são apresentadas na tabela abaixo:

Assinale a alternativa que apresenta a afirmação
CORRETA:
Observe o frasco da figura a seguir que contém uma solução aquosa de ácido sulfúrico (H2SO4) utilizada em laboratório, e responda, sabendo que o volume da solução contida no frasco é 2,0 L:
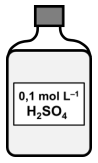
Qual o volume dessa solução necessário para obter
uma solução de 250 mL de H2SO4 com 0,025 mol L–1
?
A ocorrência de acidentes em laboratório, infelizmente, não é tão rara como possa parecer. Com a finalidade de diminuir a frequência e a gravidade desses eventos, torna-se absolutamente imprescindível que, durante os trabalhos realizados em laboratório, se observe uma série de normas de segurança. Para exemplificar o assunto são apresentadas algumas normas:
I. Evite contato de qualquer substância com a pele (evite passar os dedos na boca, nariz, olhos e ouvidos). Se alguma substância cair na sua pele, lave imediatamente com bastante água.
II. Não deixe vidro quente em local em que possa pegá-lo inadvertidamente.
III. Se algum ácido ou qualquer outro produto químico for derramado, lave o local imediatamente com uma solução básica.
IV.Os tubos de ensaio contendo líquidos devem ser aquecidos pela parte do meio e não pelo fundo e utilize pinça de madeira para esta finalidade. Quando aquecer uma substância num tubo de ensaio, não volte a extremidade aberta do mesmo para si ou para uma pessoa próxima.
V. Seja particularmente cuidadoso quando preparar soluções ácidas e básicas. No caso de solução ácida, adicione água destilada no ácido concentrado.
Assinale a alternativa correta:
Para que os resíduos de laboratório possam ser eliminados de forma adequada, é necessário ter à disposição recipientes de tipo e tamanho adequados. Os recipientes coletores devem ser caracterizados claramente de acordo com o seu conteúdo, o que também implica em se colocar símbolos de periculosidade. No caso de embalagem para resíduos químicos perigosos, pode-se afirmar que:
I. Resíduos líquidos contendo solventes devem ser armazenados em garrafas de vidro ou bombonas de material compatível.
II. Resíduos líquidos isentos de solventes devem ser armazenados em frascos metálicos ou de aço inoxidável.
III. Resíduos sólidos e lodos devem ser armazenados em recipientes (embalagens) individuais resistentes à ruptura.
Assinale a alternativa correta:
Relacione o tipo de resíduo químico (coluna à esquerda) com o respectivo exemplo (coluna à esquerda):
Tipo de Resíduos Químicos
I. Básicos
II. Metais preciosos ou recicláveis
III. Oxidantes fortes
IV. Redutores fortes (exceto metais e ligas)
V. Solventes descartáveis
VI. Solventes recicláveis
Exemplo
( ) Soluções ou sais de dicromato, permanganato, hipoclorito, iodato, persulfato, bismuto (III). Solução de bromo, iodo, peróxido de hidrogênio. Sólidos: bismutato de sódio, dióxido de chumbo e ácido crômico.
( ) Cabeça e cauda de destilação, solvente de limpeza, solventes contaminados de difícil purificação e misturas azeotrópicas.
( ) Hidrazina, soluções ou sais de sulfito, iodeto, tiossulfato, oxalato, ferro (II), estanho (II) e fósforo vermelho.
( ) Aminas, soluções de hidróxidos, soda cáustica, solução alcoolato e amônia.
( ) Solventes de HPLC, extração Sohxlet e rotaevaporados, e formol.
( ) Sais ou soluções contendo prata, ósmio, ouro, platina e rutênio.
Assinale a alternativa com a sequência CORRETA
de cima para baixo: