Questões de Concurso
Foram encontradas 11 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Curva de calibração em métodos instrumentais de análise é
O que a espectroscopia UV/Vis mede em uma amostra?
Água “dura” contém aproximadamente 2.10-3 mol L-1 de íons Ca2+. A adição de íons fluoreto à água de distribuição é uma medida preventiva contra cáries. Sabendo que para CaF₂ o Kps é 4,0.10-11, a concentração máxima de íons fluoreto, que pode ser adicionada à água dura, sem que ocorra formação de precipitados em mol L-1 é, aproximadamente,
Um analista recebeu uma amostra que contém HCl em uma concentração desconhecida. O cliente pediu o resultado da concentração de HCl em g L-1. Uma alíquota de 10,00 mL da amostra foi usada para preparar 250,00 mL de uma solução de HCl diluído. Alíquotas de 25,00 mL dessa solução diluída foram tituladas pelo método de Volhard. Para isso, adicionaram-se 50,00 mL de uma solução 0,1168 mol L-1 de AgNO3 e titulou-se com KSCN (0,1531 mol L-1), sendo gasto um volume médio de 18,55 mL.
Dados: MM (HCl): 36,45 g mol-1; MM (AgNO₃): 169,89 g mol-1; MM (KSCN): 97,18 g mol-1
A concentração de HCl da amostra expressa em g/L é
Um pesquisador solicitou a um técnico que preparasse soluções de sais de sódio utilizando os ácidos listados na tabela a seguir com uma concentração inicial de 0,500 M.
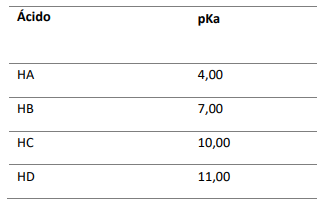
Nessa situação, a solução que terá o pH mais alto e será a mais básica é(são)
Muitas indústrias utilizam caldeiras a vapor, onde ocorrem vários problemas de obstruções devido à qualidade da água. Portanto, um dos parâmetros de controle de qualidade é a dureza da água. Um operador de indústria que processa celulose coletou uma amostra de água da caldeira e enviou ao laboratório de águas para determinação do teor de cálcio em ppm. O analista utilizou 15 mL da amostra de água, 50 mL de Eriocromo T, utilizou um tampão para chegar ao pH 10; na titulação ele gastou 5,9 mL de solução padrão de EDTA 0,02 M.
Assinale a alternativa que apresente corretamente o valor obtido de dureza da amostra de água por meio do teor de cálcio em mg/mL.
A titulação de um ácido forte e uma base fraca pode ser ilustrado pela reação do HCl e NH₄OH, conforme representada abaixo:
HCl + NH₄OH ⇄ NH₄Cl + H₂O
Assinale a alternativa que apresente corretamente o indicador mais apropriado para a titulação.
Durante uma análise espectroscópica de absorção molecular no UV/Vis, um pesquisador estava investigando a concentração de uma solução de um corante desconhecido. Ele preparou soluções de concentrações conhecidas do corante e registrou os espectros de absorção para cada uma delas. Após analisar os dados, ele observou que a relação entre absorbância e concentração não era linear. Em vez disso, ele notou um aumento exponencial na absorbância com o aumento da concentração.
Tomando como base a interação do corante com a luz na faixa do UV/Vis, assinale a alternativa correta.
A espectrometria de emissão ótica com plasma indutivamente acoplado (ICP-OES) é uma técnica multielementar bem estabelecida e econômica, usada rotineiramente para análises geoquímicas na indústria de exploração mineral. Os sistemas disponíveis variam desde instrumentos simultâneos relativamente caros, capazes de determinar com precisão e exatidão mais de 35 elementos principais e traços em menos de 2 minutos, até máquinas sequenciais muito mais baratas e mais lentas, que competem diretamente com espectrômetros de absorção atômica.
(Disponível em: JARVIS, I.; JARVIS, K. E. Inductively coupled plasma-atomic emission spectrometry in exploration geochemistry. Journal of Geochemical Exploration, Vol. 44, Issues 1–3, p. 139-200, July 1992 - tradução livre.)
Considerando a função do gás nebulizante na ICP-OES, assinale a alternativa correta.
O produto de solubilidade dos compostos é de grande importância na química analítica, pois, com seu auxílio, é possível não só explicar como também prever as reações de precipitação. Ele também tem importantes aplicações no tratamento de esgoto sanitário, na extração de minerais da água do mar, na formação e perda de ossos e dentes e no ciclo global do carbono.
(ATKINS, P.W.; JONES, L. Princípios de química – Questionando a vida moderna e o meio ambiente, 5ª Edição, 2011.)
A respeito do produto de solubilidade, analise as afirmativas a seguir:
I. A constante do equilíbrio entre um sólido e seus íons dissolvidos é chamada de produto de solubilidade, Kps, do soluto.
II. A constante do produto de solubilidade, Kps para uma solução saturada de Ca(IO3)2 em água é Kps= [Ca+2][IO-3].
III. O produto de solubilidade Kps para o sal de prata AgX é 4,0 x 10-8. A solubilidade molar do AgX em água é 2,0 x 10-4 mol L-1.
IV. A comparação dos valores de Kps não pode ser usada para prever a ordem de precipitação de sais que apresentam a mesma proporção estequiometria entre cátion e ânion.
Está correto apenas o que se afirma em
Um pesquisador está analisando uma amostra sólida de mineral utilizando a técnica de ablação a laser conjugada a um espectrômetro de massa (LA-ICP-MS). Ele ajustou os parâmetros do laser para uma energia de ablação mais alta. De acordo com o impacto que provavelmente acarretará nos resultados da análise mediante o aumento na energia do laser, é correto afirmar que