Questões de Concurso
Foram encontradas 9.182 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
I. 250 ml da solução de H2SO4(aq) 2 M. II. 6 l de uma solução H2SO4(aq) 0,5 M.
O volume aproximado de H2SO4(aq) 17,8 M necessário para preparar essa aula é:
I. Material nutriente preparado para o crescimento de microorganismos em laboratório. II. É um meio de cultura de formulação única (universal) para qualquer tipo de fungos ou bactérias. III. Devem ser estéreis, devendo ser auto-clavados. IV. Os meios de cultura líquidos são mais utilizados como meios nutrientes enquanto os meios sólidos contém agar e são utilizados para verificação da morfologia das culturas.
Estão corretas as afirmativas:
A massa de NaOH (em g) necessária para preparar a solução é:
I. Em ambos os modelos, os elétrons encontram-se em órbitas circulares, em um raio fixo. II. Ambos os modelos, os elétrons são vistos como ondas, ao invés de partículas. III. Em ambos os modelos, a energia de um elétron é quantizada, ou seja, ele pode receber ou emitir determinados valores "permitidos". IV. No modelo de Bohr, o elétron é visto como partícula, no modelo quântico, como onda. V. A energia dos elétrons e suas posições nos orbitais podem ser descritas com a equação de onda Schrödinger.
Estão corretas as afirmativas:
I. As partículas se comportam tanto como onda e como partícula. II. As moléculas não influenciam umas às outras, nunca. III. As moléculas de um gás são pontos infinitesimalmente pequenos. IV. Um gás consiste em uma coleção de moléculas em movimento aleatório contínuo.
Estão corretas as afirmativas:
1. 40,0 mg de Ar está confinado em um frasco de 0,0500 l a 27°C. 2. 40,0 mg de Kr está confinado em um frasco diferente de 0,0500 l a 27ºC.
A constante universal dos gases é 8,314462 L.kPa.K-1.mol-1. Massa molar aproximada: Ar = 40 g/mol, Kr = 80 g/mol.
Sobre o assunto, analise as afirmativas a seguir.
I. Para ter a mesma pressão do Ar, o Kr tem que estar a 600K. II. Para que os 2 gases tenham a mesma pressão, as temperaturas do Ar e do Kr devem ser iguais. III. O número de mol (n) do Kr é o dobro do número de mols do At.
Estão corretas as afirmativas:
Considerando essa situação, assinale a alternativa que contenha as pressões finais dos dois gases corretas.
Considere a estrutura química da testosterona.
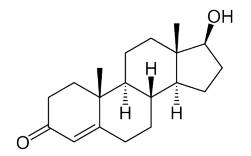
A massa molar para a estrutura química fornecida na imagem será, aproximadamente, de:
Dados de massas molares: C = 12 g/mol, H = 1 g/mol e O = 16 g/mol.
Dada a equação química
Fe + H2SO4 → Fe2(SO4)3 + H2
a soma de todos os menores coeficientes estequiométricos da
equação balanceada pelo método das tentativas é igual a
Compete ao nível representacional
A aula experimental em laboratório de química configura uma atividade cujo objetivo é exercitar a observação e evidenciar a transformação química, seja pela mudança de coloração, formação de precipitados ou liberação de gases.
O trecho foi extraído de uma apostila de aulas experimentais de química. Nesse experimento, o aluno deverá perceber a formação de um precipitado amarelo.
Com o desenvolvimento dessa atividade, o aluno poderá perceber e concluir sobre a possível ocorrência de uma reação
STRATHERN, Paul. O Sonho de Mendeleiev - A verdadeira história da Química. 2002. Zahar.
Assinale a opção que apresenta corretamente a Lei de Dalton.
A sequência de reações que ocorrem no momento da coleta é:
• Mn2+ + 2 OH- → Mn(OH)2 • 2Mn(OH)2 + O2 → 2 MnO(OH)2
Já no laboratório, a solução é acidificada e o precipitado édissolvido:
• MnO(OH)2 + 4 H+ → Mn4+ + 3 H2O • Mn4+ + 2 I- → Mn2+ + I2
O iodo formado é titulado com tiossulfato permitindo adeterminação do O2.
Nesta sequência de reações, 1 mol de I2titulado equivale a
MACHADO, A.H. Aula de Química: discurso e conhecimento. Ed. UNIJUÍ, Ijuí, 3ª ed., 2014
Neste texto, Machado critica o uso dos níveis de conhecimento que podem ser usados no ensino de Química.
Para atingir um balanço mais adequado entre os níveis, o professor poderia adotar em sua sala de aula
Embora os fosfatos não apresentem toxicidade elevada, são excelentes nutrientes e favorecem a proliferação excessiva de algas e cianobactérias. Esse fenômeno é chamado eutrofização.
A esse respeito, assinale a afirmativa incorreta.
Essa diferença de valores pode ser explicada pelas diferenças de estrutura molecular dos dois compostos e de forças intermoleculares que atuam em cada líquido.
A esse respeito, assinale V para a afirmativa verdadeira e F para a falsa.
( ) ligações dipolo-induzido que se manifestam entre moléculas de 1-propanol são responsáveis pelo seu alto ponto de ebulição. ( ) ligações de hidrogênio mantém unidas as moléculas de metoxietano e são responsáveis pelo baixo ponto de ebulição. ( ) o ponto de ebulição do 1-propanol é maior devido à ação de forças de van der Waals.
As afirmativas são, respectivamente,