Questões de Concurso
Foram encontradas 8.691 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Texto 13A6-I

Texto 13A6-I

Texto 13A6-I

Texto 13A6-I

Texto 13A6-I

O chumbo (Pb) é um metal potencialmente tóxico encontrado em diversas matrizes ambientais. Para determinação de Pb em água, pode-se empregar a técnica de espectrometria de absorção atômica. Considerando a técnica apresentada, julgue os itens a seguir.
I A relação entre a quantidade de luz absorvida e a concentração do analito em padrões conhecidos pode ser usada para determinar concentrações desconhecidas.
II A instrumentação básica requer fonte de luz primária, sistema de atomização, monocromador e detector.
III O sistema queimador-nebulizador é um limitante e possui algumas desvantagens na técnica de absorção atômica em chama.
Assinale a opção correta.
A química verde desenvolve tecnologias limpas a fim de reduzir ou eliminar substâncias prejudiciais à saúde e ao meio ambiente. Entre os princípios da química verde, incluem-se a
I recuperação de áreas degradadas e a proteção dos ecossistemas.
II qualidade ambiental e o uso de matérias-primas renováveis.
III prevenção e a redução de derivados.
Assinale a opção correta.
Considerando-se a 26.ª Conferência das Partes sobre Mudança Climática da ONU (COP26), que resultou no documento Pacto Climático COP26 de Glasgow, julgue os itens seguintes acerca de combustíveis fósseis e mudanças climáticas.
I O carvão é considerado o maior contribuinte individual para as mudanças climáticas.
II Um dos objetivos do COP26 é a criação de fundo de energia renovável de US$ 40 bilhões até 2030.
III A Conferência determinou que se deve reduzir as emissões de gases de efeito estufa até 2030 para que a meta de 1,5 ºC possa ser mantida.
Assinale a opção correta.
Para produzir alimentos em quantidade e qualidade, é necessário o uso de pesticidas ou agrotóxicos. Um pesticida bastante utilizado nas culturas de frutas e hortaliças é o herbicida 2,4-D. Considerando que essas substâncias podem deixar resíduos nos alimentos, em uma análise de 100 g de morango foram encontrados 0,10 mg desse herbicida.
De acordo com o texto, a concentração, em partes por milhão (ppm), do herbicida 2,4-D encontrada na referida análise é igual a
Atualmente, o combustível utilizado nos automóveis contém 27% em volume de etanol (álcool etílico) misturado à gasolina (octano).
F. Amarato e F. Matoso. Mistura de etanol na gasolina.
Internet: <http://g1.globo.com/economia/noticia/2015/03/mistura-de-etanol-na-gasolina-sobe-para-27-partir-de-16-de-marco.html>(com adaptações).
Considerando que foram usados 20,0 L do combustível referido no texto para abastecer um veículo, que as densidades do etanol e do octano sejam, respectivamente, 0,789 g/mL e 0,700 g/mL e que o combustível em questão seja formado exclusivamente por etanol e octano, é correto afirmar que a densidade do combustível é
A cromatografia gasosa acoplada a um espectrômetro de massas (CG/EM) pode ser usada para quantificar óleos essenciais. Considere que determinado químico tenha recebido amostra contendo cinamaldeído e eugenol dissolvidos em CH2Cl2. A análise cromatográfica dessa amostra apresentou o cromatograma de ionização total — TIC (total ionisation chromatogram) — mostrado na figura 13A4-I a seguir. A integração do cromatograma revelou que o tempo de retenção do cinamaldeído foi de 8,9 min e a área sob o pico foi de 6.775.518 unidades arbitrárias; ao passo que o eugenol apresentou tempo de retenção de 10,0 min e área sob o pico de 4.143.349 unidades arbitrárias. Para determinar as concentrações dos óleos essenciais presentes na amostra, o químico preparou curvas-padrão de calibração, conforme ilustrado na figura 13A4-II a seguir, em que a abscissa apresenta concentrações dos óleos em µL/mL.
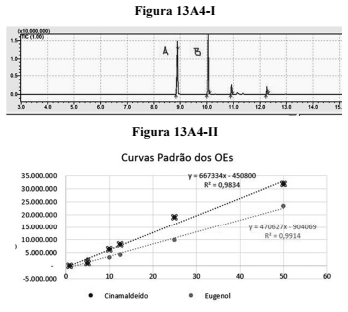
Considerando as informações apresentadas, é correto afirmar que
a concentração de ambos os óleos essenciais na amostra é
Uma amostra que pode conter hidróxido de sódio (NaOH), bicarbonato de sódio (NaHCO3) e carbonato de sódio (Na2CO3), isoladamente ou em misturas binárias ou ternárias, foi titulada potenciometricamente com uma solução aquosa de ácido clorídrico. A curva de titulação ácido-base experimental dessa titulação é a mostrada na figura a seguir.
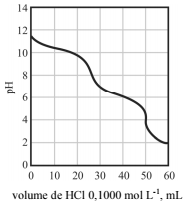
De acordo com o texto e o resultado da curva de titulação
ácido-base, é correto afirmar que a amostra em questão contém
Suponha que em um cilindro provido de um pistão móvel sem atrito seja realizada a combustão completa de determinada quantidade de etanol líquido, conforme equação química a seguir, em um processo isotérmico e isobárico em que os gases presentes se comportam idealmente e o volume da fase líquida é constante.
C2H5OH (l) + 3 O2 (g) → 2 CO2 (g) + 3 H2O (l)
Do ponto de vista termodinâmico, nesse processo, o(a)
O chumbo metálico pode ser produzido pela redução de minério de chumbo com coque em reator com controle de pressão, em um processo reversível conforme a equação química a seguir, cuja variação de entalpia nas condições padrão é igual a 42 kJ/mol.
2 PbO (s) + C (s) ⇌ 2 Pb (s) + CO2 (g)
Nessas condições, o rendimento do processo em quantidade de matéria pode ser aumentado pela
A cinética de decomposição do brometo de nitrosila em óxido nítrico e bromo, conforme equação química mostrada a seguir, pode ser expressa pela lei de velocidade d[NOBr]/dt = −kˑ[NOBr]2 , em que [NOBr] representa a concentração de brometo de nitrosila em mol/L; t, o tempo de reação em segundos; e k, a constante cinética do processo.
2 NOBr (g) → 2 NO (g) + Br2 (g)
Sob condições experimentais, em que a constante cinética da reação em apreço vale 2 L ˑ mol−1 ˑ s−1, assinale a opção que corresponde ao tempo de meia vida do processo quando se parte de uma concentração de 0,1 mol/L de brometo de nitrosila.
Na figura a seguir é esboçado o gráfico do fator de compressibilidade dos gases genéricos A e B, em função da pressão, sob temperatura ambiente.
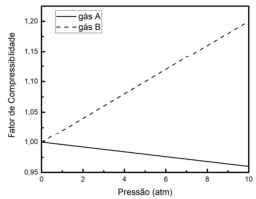
Em relação ao gás A, sob temperatura ambiente e na faixa de
pressões mostrada, o gás B apresenta
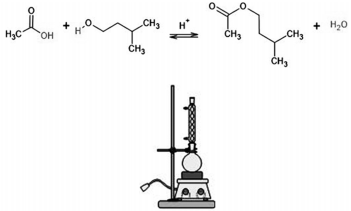
Os ésteres estão presentes em composições de flavorizantes para adição em alimentos. Essas substâncias não fazem ligações de hidrogênio. Tanto no laboratório quanto na indústria, eles são facilmente preparados pela reação entre um ácido carboxílico e um álcool. As figuras precedentes mostram a reação química da síntese do acetato de isoamila e o sistema de reação utilizado nessa síntese.
Considerando essas informações, assinale a opção correta.
Amidas são compostos que têm a estrutura genérica:
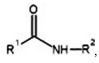
em que R1 e R2 representam cadeias carbônicas. Esses compostos podem ser preparados pela reação entre um ácido carboxílico e uma amina, tal como ilustrado na equação a seguir, a qual representa uma reação entre os aminoácidos glicina e cisteína que produz o composto A.
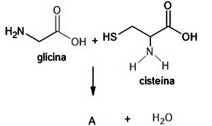
Acerca desse assunto e considerando que MH = 1 g/mol;
MC = 12 g/mol; MN = 14 g/mol; MO = 16 g/mol; MS = 32 g/mol,
assinale a opção correta.