Questões de Concurso
Foram encontradas 8.691 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
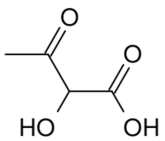
O número de isômeros ópticos ativos correspondentes a essa estrutura é igual a:
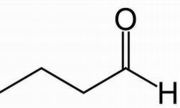
Essa substância pertence à função orgânica oxigenada denominada:
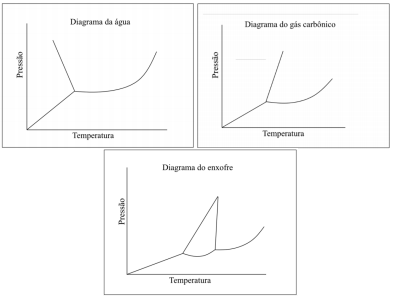
A água é um composto que apresenta um equilíbrio da fase líquido-sólido anômalo, conforme visto nos diagramas. Essa singularidade, em relação aos demais compostos, deve-se:
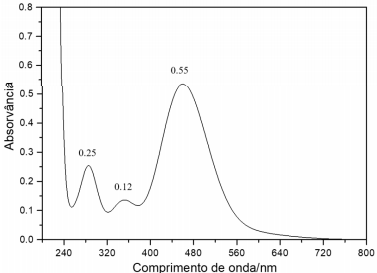
Esse espectro está relacionado com a seguinte tabela:
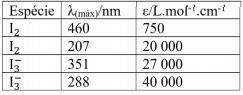
É sabido que uma solução aquosa de iodo apresenta equilíbrio químico com uma impureza de iodeto e forma o íon tri-iodeto, assim a pesagem direta não fornece informações suficientes para encontrar a concentração dessa espécie. Conhecendo as absortividades molares e a absorvância do experimento, a concentração de iodo é: (Dados: caminho óptico da cubeta = 1 cm)
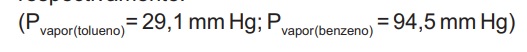
O tempo de retenção desses compostos com a fase estacionária está relacionado com as forças intermoleculares, ou seja, polaridades semelhantes serão fortemente atraídas. Sabendo que a fase estacionária está saturada de água, o composto retido por mais tempo é o:
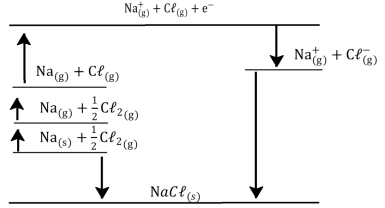
energia de ionização do Na = + 496 kJ.mol – 1 afinidade eletrônica do Cℓ = + 349 kJ.mol – 1 entalpia de atomização Na = + 107 kJ.mol – 1 entalpia de atomização Cℓ = + 122 kJ.mol entalpia padrão de formação do NaCℓ = – 411 kJ.mol – 1
A entalpia de rede do cloreto de sódio é:
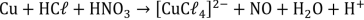
A soma dos menores coeficientes inteiros que balanceiam a equação é:
A partir da 2ª Lei da Termodinâmica o conceito
de entropia foi criado, a fim de explicar a direção de
um processo ou transformação. Sendo assim, a
entropia total é uma medida de desordem que:

Para melhorar o rendimento dessa síntese, duas modificações podem ser feitas sobre o sistema:
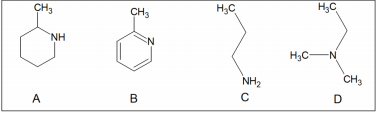
Os compostos de coordenação podem ser entendidos como o produto da reação entre um ácido de Lewis, o centro metálico, e uma base de Lewis, o ligante. Analisando a estrutura desses ligantes entende-se que quanto maior a basicidade mais forte é a interação entre ligante e metal, ou seja, maior força de ligação. Considerando o mesmo centro metálico, a ordem crescente de força de ligação em relação aos ligantes é:
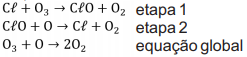
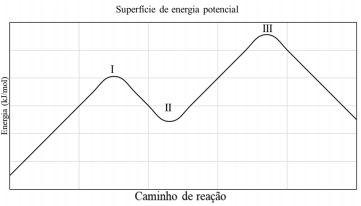
Ao comparar o mecanismo com a SEP, pode-se concluir que a espécie II indicada no diagrama é o:
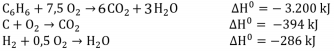
Conclui-se que o ΔH de formação do benzeno é:
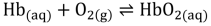
(Onde Hb é a hemoglobina e HbO é oxi- 2 hemoglobina.) O rendimento físico de um atleta está ligado, entre outros fatores, à capacidade de metabolizar oxigênio, o que pode ser prejudicado pela altitude na qual a atividade física está sendo realizada. Assim, um atleta acostumado a treinar no Rio de Janeiro (nível do mar) tem seus resultados físicos prejudicados quando compete na Cidade do México (2250 m acima do nível do mar) pois, nessa altitude, a pressão:
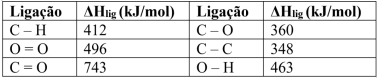
Sabendo que o etanol é vaporizado (ΔHvap = 43,5 kJ/mol) no motor de combustão antes da sua reação com o oxigênio, a entalpia de combustão do etanol líquido é: