Questões de Concurso
Foram encontradas 8.691 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Considerando essa situação e o fato de que o experimento de titulação é uma das formas de se avaliar se uma solução apresenta propriedade tamponante, assinale a opção correta.
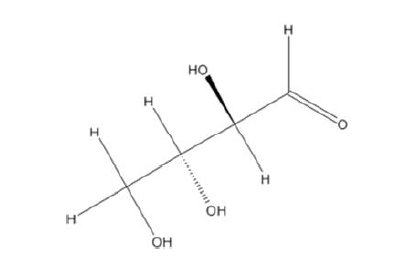
Considerando a estrutura química da D-eritrose, apresentada na figura anterior, assinale a opção que contém o número total de estereoisômeros para essa molécula orgânica.
De acordo com aspectos da isomeria espacial, é correto afirmar que, na situação hipotética apresentada, pode ter sido utilizada uma solução com
reação 1: HCO2H (l) + H2O (l) ⇌ H3O+ (aq) + HCO2 – (aq) reação 2: CH3NH2 (l) + H2O (l) ⇌ CH3NH3 + (aq) + OH– (aq)
A partir dessas informações, assinale a opção que apresenta os pares conjugados ácido/base para as reações 1 e 2, respectivamente, considerando a reação direta, ou seja, o reagente ácido e sua respectiva base conjugada.
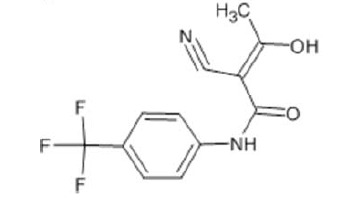
Na estrutura química da teriflunomida, existem
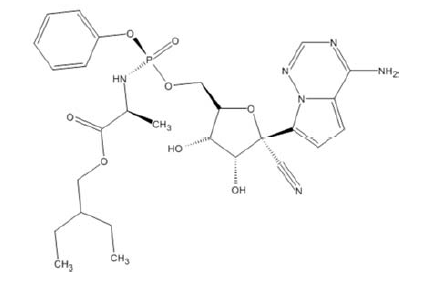
De acordo com a estrutura química apresentada, é correto afirmar que os grupos funcionais do remdesivir incluem
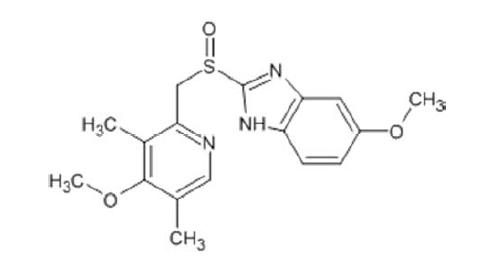
Considerando-se a estrutura química do esomeprazol, bem como M(H) = 1,00 g/mol, M(C) = 12,00 g/mol, M(N) = 14,00 g/mol, M(O) = 16,00 g/mol e M(S) = 32,00 g/mol, é correto afirmar que sua fórmula molecular e sua massa molar são, respectivamente,
O álcool estearílico é usado na indústria de cosméticos para a produção de cremes, loções, máscaras capilares, entre outros, por ser compatível com vários tipos de emulsionantes e apresentar baixa irritabilidade na pele.

O álcool estearílico é usado na indústria de cosméticos para a produção de cremes, loções, máscaras capilares, entre outros, por ser compatível com vários tipos de emulsionantes e apresentar baixa irritabilidade na pele.

I O aumento da pressão aumentou a velocidade da reação até atingir o limite desse parâmetro, pois, com o aumento da pressão de H2, mais hidrogênio foi dissolvido na solução.
II O aumento da pressão aumentou a velocidade da reação, o que comprova que a reação é de 1.ª ordem em relação ao hidrogênio.
III O fato de haver um limite para o aumento da velocidade da reação devido à pressão indica que existe uma capacidade limitada do catalisador de suportar o H2.
Assinale a opção correta.
O álcool estearílico é usado na indústria de cosméticos para a produção de cremes, loções, máscaras capilares, entre outros, por ser compatível com vários tipos de emulsionantes e apresentar baixa irritabilidade na pele.

NO (g) + O3 (g) ⇌ NO2 (g) + O2 (g)
Estudos mostraram que, quando esses dois gases são colocados em um mesmo recipiente a 25 °C e 1 atm, cada molécula colide, em média, cerca de um bilhão de vezes por segundo com outras moléculas. Se todas essas colisões resultassem em formação de produto, a reação aconteceria em uma fração de segundo. Porém, não é isso que se observa empiricamente, sendo a reação muitíssimo mais lenta.
Nesse caso, para que a reação aconteça, a simples colisão entre as moléculas não é suficiente; é necessário, também, que
Com base nessas informações, é correto afirmar que, se as concentrações iniciais de quinina e de ácido forem, respectivamente, de 0,250 mol/L e 0,160 mol/L, então a velocidade inicial da reação será igual a
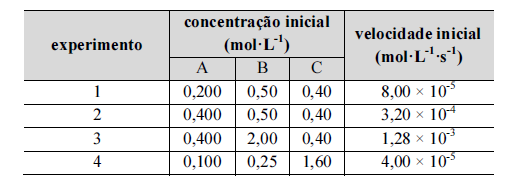
Com relação à situação hipotética precedente, assumindo-se v como a velocidade da reação e k como a constante de velocidade, é correto afirmar que a lei de velocidade dessa reação é dada por