Questões de Concurso
Foram encontradas 8.674 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
O primeiro modelo atômico que, baseado em método científico, explicou a natureza elétrica da matéria foi proposto por John Dalton, no século XIX.
Tendo como referência o assunto tratado no texto precedente, julgue o item que se segue.
Em reações reversíveis, a transformação de reagentes em
produtos continua a acontecer mesmo depois de atingido o
estado de equilíbrio químico.
Tendo como referência o assunto tratado no texto precedente, julgue o item que se segue.
Apesar de assemelhar-se a um produto líquido, o petróleo
cru é uma emulsão constituída por componentes no estado
líquido, no qual estão dispersos componentes gasosos e
sólidos.
Tendo como referência o assunto tratado no texto precedente, julgue o item que se segue.
Considere que o dióxido de enxofre (SO2) liberado na atmosfera sofra oxidação ao reagir com o gás oxigênio (O2), produzindo SO3, de acordo com a reação demonstrada a seguir, e que a reação tenha atingido o estado de equilíbrio.
2 SO2 (g) + O2 (g) ⇌ 2 SO3 (g)
Nesse caso, o estado de equilíbrio em questão pode ser
alterado pela variação da pressão atmosférica.
Tendo como referência o assunto tratado no texto precedente, julgue o item que se segue.
A queima de combustíveis derivados do petróleo que
contenham enxofre e nitrogênio gera óxidos (NOx, SO2 e
SO3) tóxicos para a saúde humana e prejudiciais ao
ambiente.
A partir dessas informações e considerando que MH = 1 g/mol, MC = 12 g/mol, e MO = 16 g/mol, que o volume molar de um gás ideal seja de 22,4 L e que todos os gases se comportem de forma ideal, julgue o item a seguir.
Para que 0,2 mol de n-heptano seja totalmente consumido
na queima, a massa de O2 disponível deve ser maior ou igual
a 70,4 g.
A partir dessas informações e considerando que MH = 1 g/mol, MC = 12 g/mol, e MO = 16 g/mol, que o volume molar de um gás ideal seja de 22,4 L e que todos os gases se comportem de forma ideal, julgue o item a seguir.
A massa de H2O (g) produzida pela queima de 500 g desse
combustível, com excesso de O2, é maior que 700 g.
A partir dessas informações e considerando que MH = 1 g/mol, MC = 12 g/mol, e MO = 16 g/mol, que o volume molar de um gás ideal seja de 22,4 L e que todos os gases se comportem de forma ideal, julgue o item a seguir.
A combustão do n-heptano é um tipo de reação química
reversível.
A partir dessas informações e considerando que MH = 1 g/mol, MC = 12 g/mol, e MO = 16 g/mol, que o volume molar de um gás ideal seja de 22,4 L e que todos os gases se comportem de forma ideal, julgue o item a seguir.
A instalação e a operação de tanques subterrâneos de
combustíveis requerem cuidados especiais para que se
evitem vazamentos, principalmente nos postos à beira-mar,
onde a proximidade da água salina pode acelerar o processo
de corrosão devido às reações de oxirredução.
Um exemplo clássico de uma reação química em
equilíbrio é a reação entre o monóxido de
nitrogênio (NO) e o dióxido de nitrogênio (NO): 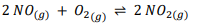
Nesta reação, o monóxido de nitrogênio (NO) reage com o oxigênio (O2) para formar dióxido de nitrogênio (NO2), e também ocorre a reação reversa, na qual o dióxido de nitrogênio (NO2) se decompõe para formar monóxido de nitrogênio (NO) e oxigênio (O2).
Assinale a alternativa que contém a equação para a constante de equilíbrio (KC) para esta reação.
O petróleo é uma mistura complexa composta, em grande parte, por hidrocarbonetos. Julgue o próximo item, a respeito dos hidrocarbonetos.
Os hidrocarbonetos aromáticos, como o benzeno, são
compostos orgânicos em cuja estrutura há, pelo menos, um
anel benzênico.
Os hidrocarbonetos são compostos que consistem de apenas átomos de carbono e de oxigênio.
A estequiometria é aplicada em diversos estudos sobre a composição química de compostos e suas transformações químicas. No que se refere à estequiometria, julgue o item a seguir.
A estequiometria de uma reação apresenta a relação
qualitativa de reagentes formados e de produtos consumidos
nas diversas reações químicas indicadas por uma equação
química.
Caso o petróleo extraído de um poço esteja armazenado em um tanque metálico por um tempo longo e suficiente para que esse petróleo esteja em equilíbrio térmico com as paredes do tanque e o meio externo, então, nessa situação, não haverá trocas de energia térmica entre o petróleo e o meio externo.
A respeito das reações de oxirredução e dos ensaios não destrutivos, julgue o próximo item.
Quanto mais eletropositivo um elemento for, maior será sua
tendência de ganhar elétrons.
Acerca de funções químicas, julgue o item a seguir.
Bases são caracterizadas pela liberação de íons OH−
e serão
tão mais fortes quanto mais estáveis forem suas fases não
ionizadas.
Acerca de funções químicas, julgue o item a seguir.
Os ácidos fortes são aqueles que se ionizam completamente
em solução aquosa, liberando todos os seus íons H+
, tendo
alta capacidade de doar prótons (íons H+
).
Acerca de funções químicas, julgue o item a seguir.
O potencial de neutralização de um ácido forte é maior em
um ácido fraco que em uma base forte.
Julgue o item a seguir, a respeito de dilatação térmica.
Para um material isotrópico, o coeficiente de dilatação
volumétrico (y) se relaciona com o coeficiente de dilatação
linear (a) por meio da equação 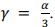
Julgue o seguinte item, em relação à eletroquímica.
Os potenciais-padrão das semirreações de oxirredução são
medidos com base no eletrodo-padrão de hidrogênio, cujo
valor estabelecido é 0,00 V.