Questões de Concurso
Foram encontradas 8.706 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
O processo denominado de Hall-Héroult, que se constitui na eletrólise ígnea da alumina fundida (Al2 O3 ) na criolita (Na3 AlF6 ), foi patenteado por Charles M. Hall para a obtenção industrial alumínio puro.
A equação química total:
4Al+3(fundido) + 3C(grafita) + 6O–2(fundido) → 4Al(l) + 3CO2 (g)
Calcule, respectivamente, as quantidades de grafita consumida e a massa de CO2 (g) formado quando da produção de 2.700,0 kg de alumínio.
Identifique abaixo as afirmativas verdadeiras ( V ) e as falsas ( F ).
( ) O valor numérico da constante de equilíbrio de reações químicas sofre alteração quando há variação da temperatura da reação.
( ) A velocidade de reações químicas é alterada pela presença de catalisadores e estes (catalisadores) são totalmente consumidos durante a reação.
( ) A diminuição da temperatura de uma reação exotérmica desfavorece a formação de produtos.
( ) O tempo necessário para que a concentração do reagente se reduza a um quarto da concentração inicial é denominado de meia-vida.
( ) As leis de velocidades são determinadas experimentalmente e geralmente não podem ser escritas a partir da estequiometria da equação química da reação.
Assinale a alternativa que indica a sequência correta, de cima para baixo.
Sabendo-se que o cloreto de prata, AgCl, e o brometo de prata, AgBr, são muito pouco solúveis em soluções aquosas, calcule o produto de solubilidade das substâncias pouco solúveis a partir das suas solubilidades molares:
1. AgCl = 1,265 × 10–5 mol.L–1
2. AgBr = 8,800 × 10–7 mol.L–1
Assinale a alternativa correta.
Há diversas formas de expressar concentração de reagentes em solução ou misturas.
Relacione corretamente as colunas 1 e 2 abaixo.
Coluna 1 Nomenclatura
1. molalidade
2. molaridade
3. fração molar
4. porcentagem massa/massa
Coluna 2 Definições
( ) Relação entre o número de mol do soluto e o volume da solução em litros.
( ) Quociente entre o número de mol do soluto e o número de mol total da solução.
( ) Quociente entre a massa do soluto em gramas e a massa da solução em gramas multiplicado por 100%.
( ) Relação do número de mols do soluto e a massa do solvente em quilogramas.
Assinale a alternativa que indica a sequência correta, de cima para baixo.
O acumulador de Chumbo, também conhecido como bateria chumbo-ácido, é utilizado nos automóveis com objetivo de fornecer corrente elétrica para iniciar a ignição do motor e também para a iluminação.
A reação total pode ser representada pela equação:
αPb(s) + βPbO2 (s) + γH2 SO4 (aq) → ψPbSO4 (s) + ωH2 O(l)
Balanceie a equação esquemática e responda às seguintes questões:
1. a sequência correta dos coeficientes estequiométricos α, β, γ, ψ e ω.
2. agente oxidante.
3. agente redutor.
Assinale a alternativa que responde corretamente às questões numeradas.
A Natureza desenvolveu moléculas, aqui designados de “X”, que contêm as instruções genéticas que coordenam a reprodução, o desenvolvimento e funcionamento de todos os seres vivos e alguns vírus, e que transmitem as características hereditárias de cada ser vivo. A sua principal função é armazenar as informações necessárias para a construção de proteínas especiais.
Essa molécula “X”, utilizada pela Natureza para carregar a informação genética de uma geração de células para a próxima, é chamada de:
Para a reação abaixo:
αCr3+(aq) + βMnO2 (s) + γOH– → ρMn2+(aq) + ψCrO4 2–(aq) + ωH2 O(l)
Balanceie a equação esquemática e assinale a alternativa que indica a sequência correta dos coeficientes estequiométricos α, β, γ, ρ, ψ e ω
dentifique abaixo as afirmativas verdadeiras ( V ) e as falsas ( F ).
( ) De acordo com o princípio da conservação da energia, a energia não pode ser criada nem destruída, mas somente transformada de uma espécie em outra.
( ) O estado de equilíbrio químico ocorre no momento em que o sistema reacional estaciona e a reação é completada.
( ) Aproximadamente 1,3 kW m-2 da energia radiante solar atinge a Terra, porém somente cerca de 5% desta energia é convertida em carboidratos pela fotossíntese.
( ) Denomina-se “processo exotérmico” aquele que absorve calor e apresenta ∆H > 0.
( ) Aumentar a quantidade dos reagentes é a única maneira de se elevar o valor da constante de equilíbrio de uma reação química.
Assinale a alternativa que indica a sequência correta, de cima para baixo.
Num reator em forma de balão com capacidade de 1,0 litro, numa temperatura de 100,0°C, foram adicionados 1,0 mol de H2 (g) e 1,0 mol de I2 (g).
A figura abaixo apresenta a variação das concentrações com o tempo de H2 (g), I2 (g) e de HI(g).
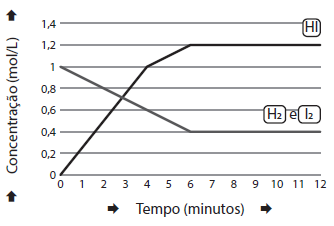
A reação é representada pela equação:
H2
(g) + I2
(g) → 2HI(g)
O valor da constante de equilíbrio é igual a:
Considerando os seguintes dados, calcule o calor de combustão do etino, C2 H2, conhecido comercialmente como acetileno.
2C(grafite) + H2 (g) → C2 H2 (g) ∆Hf0 = +226,73 kJ.mol–1
C(grafite) + O2 (g) → CO2 (g) ∆Hf0 = –393,51 kJ.mol–1
H2 (g) + ½O2 (g) → H2 O(l) ∆Hf0 = –285,83 kJ.mol–1
O calor de combustão do acetileno, (∆Hr0 ), é:
Considere certa reação química, representada pela equação genérica abaixo:
A + B → Produtos
Na temperatura de 20°C, apresenta um lei de velocidade (V1 ), V1 = k.[A].[B].
Qual será a sua lei de velocidade (v2 ) na temperatura de 30°C, admitindo-se que essa reação obedece ao princípio de Van’t Hoff, nas mesmas concentrações iniciais dos reagentes.
Analise as afirmativas a seguir:
1. A massa atômica de certo elemento que é apresentada na tabela periódica corresponde à média ponderal das massas atômicas dos seus isótopos naturais.
2. Os nêutrons são partículas subatômicas com carga positiva e têm aproximadamente a mesma massa do elétron.
3. Os isótopos de um elemento têm o mesmo número atômico, mas diferentes números de massa.
4. Para um elemento neutro, a soma do número de prótons e de nêutrons corresponde ao seu número de massa.
5. A disposição dos elementos na tabela periódica está baseada no número atômico do elemento que corresponde à soma dos seus prótons e de seus elétrons.
Assinale a alternativa que indica todas as afirmativas corretas.
Quando o dicromato de sódio, Na2 Cr2 O7 , numa reação química se transforma em sulfato de crômio, Cr2 (SO4 ) 3 , cada átomo de crômio:
Considere: Massa Molar NaF= 42 e F= 19.
No que diz respeito a reações orgânicas e a métodos de separação, julgue o item
A cromatografia é um método que permite a
identificação e a determinação de componentes em
misturas complexas, com base nas diferenças de
velocidade em que são transportados por meio de uma
fase móvel sólida, líquida ou gasosa. Na cromatografia
gás‐líquido, um gás transporta a amostra sobre uma fase
sólida estacionária, com a adsorção dos componentes
separados em diferentes graus.
No que diz respeito a reações orgânicas e a métodos de separação, julgue o item
Saponificação é a reação de hidrólise básica de uma
gordura ou óleo, em que são formados glicerol e um
sabão. Nessa reação, ocorre a clivagem de um grupo
éster para regenerar o álcool e o ácido dos quais o éster
foi derivado, ou seja, é o processo no qual um éster é
hidrolisado em solução alcalina para formar um álcool e
uma base conjugada.