Questões de Concurso
Foram encontradas 9.182 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Fe2 O3 (s) + 3 CO(g) → 2 Fe(s) + 3 CO2 (g) equação (1)
Utilizando as equações termoquímicas abaixo:
CO(g) + 1/2 O2 (g) → CO2 (g) ΔH° = -283,0 kJ 2 Fe(s) + 3/2 O2 (g) → Fe2 O3 (s) ΔH° = -822,3 kJ
é CORRETO afirmar que o valor do ΔH para a equação (1) é
Sabe-se que, a 25°C, o equilíbrio se arranja de modo a formar 0,10 mols de N2 O4 e 0,02 mols de NO2 . A 90 °C são formados 0,050 mols de N2 O4 e 0,12 mols de NO2 .
Sabendo disso, é CORRETO concluir que
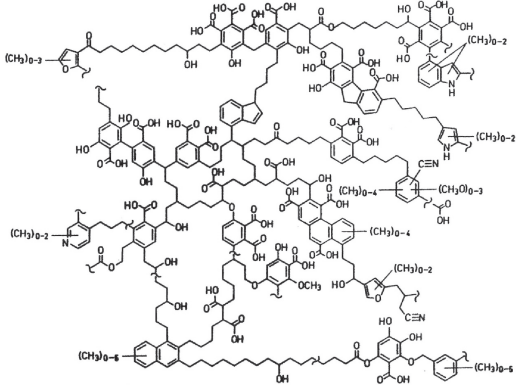 SCHULTEN, H.R. & SCHNITZER, M. Chemical model structures for soil organic matter and soils.SoilSci. 162: 115-130, 1997.
SCHULTEN, H.R. & SCHNITZER, M. Chemical model structures for soil organic matter and soils.SoilSci. 162: 115-130, 1997.Na estrutura apresentada, é CORRETO afirmar que identificamos
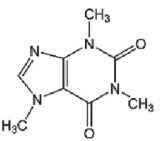
Analisando a molécula de cafeína, é CORRETO afirmar que
Para os seguintes compostos orgânicos abaixo, contendo 3 átomos de carbono cada um, espera-se que o que apresente a maior temperatura de ebulição seja
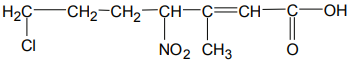
O nome IUPAC para o seguinte composto é:
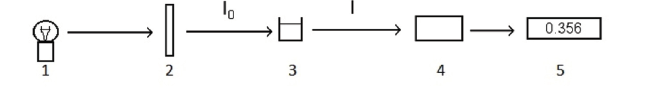
Baseado no diagrama apresentado, escolha a alternativa INCORRETA
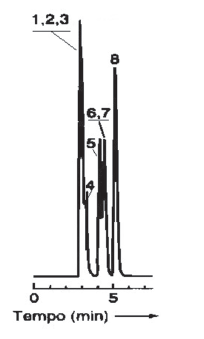
Em relação ao seguinte cromatograma gasoso, obtido isotermicamente, a 70 °C, em uma coluna capilar apolar de 40 metros, com um detector de ionização de chama (DIC), é INCORRETO afirmar que
A figura abaixo ilustra a eluição de uma amostra e de duas substâncias puras, a e B, em uma cromatoplaca. Antes da Eluição Após da Eluição

 Frente do eluente
Frente do eluenteDe acordo com a figura, é CORRETO afirmar que
Considere o procedimento a seguir:
Uma massa de 1,0000g de uma amostra contendo cloreto foi dissolvida e transferida quantitativamente para balão volumétrico de 100,0 mL, que teve seu volume completado com água destilada. Uma alíquota de 20,00 mL deste balão foi transferida para um erlenmeyer, ao qual adicionaram-se 30,00 mL de AgNO3 0,0500 mol L-1 para precipitar o AgCl. Após a filtração e lavagem do precipitado, com transferência quantitativa do filtrado para outro erlenmeyer, o excesso de Ag+ foi titulado com 15,00mL de NH4 SCN 0,0500mol L-1.
Em relação à determinação descrita é INCORRETO afirmar que
A reação da glicose (C6 H12O6 ) com o reagente de Tollens ocorre segundo a seguinte reação: C6 H12O6 (aq) + 2 Ag+(aq) + 2 OH- (aq) ⥨ C6 H12O7 (aq) + 2 Ag(s) + H2 O(l)
Em função da reação apresentada, é CORRETO afirmar que
Tabela: solubilidade de A em água a diversas temperaturas Temperatura (°C) 10 20 30 40 50 60 Concentração de A (mg mL-1) 3 6 9 12 15 18
Analisando os dados da tabela, é CORRETO afirmar que
a I2 O5 (s) + b CO(g) ⥨ c I2 (g) + d CO2 (g) e I2 (aq) + f S2 O3 2-(aq) ⥨ g I- (aq) + h S4 O6 2-(aq)
Após balanceadas as equações, é CORRETO afirmar sobre os coeficientes de balanceamento que
I. 100,00 mL de ácido acético (CH3 COOH) 0,124 mol L-1 (pKa = 4,74) com 25,00 mL de hidróxido de potássio (KOH) 0,248 mol L-1. II. 50,00 mL de hidróxido de amônio (NH4 OH) 0,02 mol L-1 (pKb = 4,74) com 50 mL de cloreto de amônio (NH4 Cl) 0,2 mol L-1. III. 25,00 mL de ácido perclórico (HClO4 ) 0,05 mol L-1com 50,00 mL de hidróxido de potássio (KOH) 0,04 mol L-1.