Questões de Concurso
Foram encontradas 8.706 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
A figura a seguir apresenta duas curvas quase que sobrepostas, correspondentes ao mesmo procedimento: a curva de titulação entre um fármaco ácido e NaOH e a curva obtida quando se tira a 1ª derivada da curva de titulação. Analise as afirmações e escreva V para verdadeiro ou F para falso:
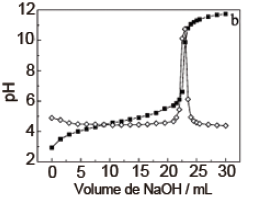
( ) A titulação envolve ácido fraco e base forte, se não fosse potenciométrica a utilização de fenolftaleína como indicador, teria preferência a utilização de alaranjado de metila.
( ) O p.e. (ponto de equivalência) será em pH igual 7.
( ) o pKa do titulado é próximo a 5.
( ) A derivada da curva tem por finalidade indicar o volume gasto até o p.e. para a neutralização.
( ) O sitema atua como um tampão na faixa 4<pH<5,5.
Assinale a alternativa correta quanto ao verdadeiro ou falso:
Um medicamento à base de ferro pode ter sua concentração conhecida por espectrofotometria UV/ Visível. Utilizando-se um medicamento de referência, realizaram-se as devidas diluições para a construção de uma curva de calibração. As medidas de absorbância, no comprimento de onda de absorção máxima de 510 nm, nas diferentes concentrações do medicamento de referência encontram-se na tabela a seguir:
Concentração (ppm) Absorbância
2,00 0,164
5,00 0,425
8,00 0,628
12,00 0,951
16,00 1,260
20,00 1,582
Os dados obtidos permitiram a construção de uma curva de calibração com coeficiente de correlação (R2) de 0,99978 e equação da reta: A = 0,01478 + 0,07812 x C. Sabendo-se que a absorbância da solução do medicamento à base de ferro foi de 0,715. Analise as propostas:
I. A concentração da amostra analisada é de 8,96 ppm.
II. O analito deve ser colorido, pois o comprimento de onda é na região do visível.
III. A absorbância está relacionada diretamente com a quantidade de radiação que atravessou a amostra analisada.
IV. A curva de calibração construída não se mostrou linear para o trecho estudado.
V. Se a amostra apresentar um valor de absorbância de 1,782 a concentração será de 22,60 ppm.
São corretas:
Com base nos seus conhecimentos sobre LC, no texto e nas estruturas das moléculas assinale o que está correto:
A análise quantitativa por espectrofotometria UV/Visível é muito utilizada para doseamento de determinados princípios ativos e corantes em formulações farmacêuticas disponíveis no mercado. Essa análise é confiável desde que obedeça a Lei de Beer, ou seja, a solução analisada deve obrigatoriamente seguir uma relação linear entre a absorbância e a concentração.
Considere a análise de um determinado fármaco que obedece a Lei de Beer. O que aconteceria com o valor de Absorbância se a concentração da solução do fármaco fosse o dobro? Considere que para esta análise utilizou-se uma cubeta de 1,00 cm de caminho óptico. O que aconteceria com o valor de Absorbância se uma nova medida fosse realizada com uma cubeta de 5,00 cm de caminho óptico?
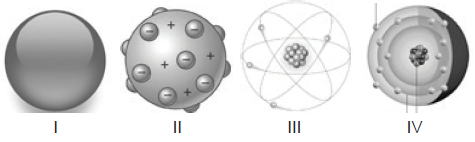
A constituição da matéria está presente no vocabulário científico desde a Grécia antiga, mas sem comprovação científica, apenas filosófica. Como conhecimento científico os modelos atômicos foram formulados a partir de 1808 e à medida que novos e melhores métodos de investigação foram sendo desenvolvidos, evoluídos. A seguir, são apresentadas as representações gráficas de alguns modelos atômicos:
Julgue os itens a seguir:
( ) Dalton, figura I, tomou como base para o desenvolvimento de seu modelo atômico análises de conservação e proporcionalidade da massa em uma reação, originárias de Lavoisier e Proust.
( ) O modelo atômico de Thomson , figura II, apresenta a ideia de descontinuidade pela primeira vez e apresenta a primeira subpartícula atômica encontrada: o elétron.
( ) A figura III representa o modelo atômico de Rutherford, destacando o surgimento da ideia de núcleo positivo, sem os nêutrons que só seriam descobertos por Sommerfeld em 1932.
( ) A figura IV representa o átomo de Chadwick, organizando os níveis de energia eletrônicos pela primeira vez.
Assinale a alternativa que contém a análise correta em verdadeiro (V) e falso (F) para os itens apresentados.
Uma das etapas de enriquecimento do urânio consiste na separação do hexafluoreto de urânio, contendo U-235 do U-238, analise o esquema representado a seguir:
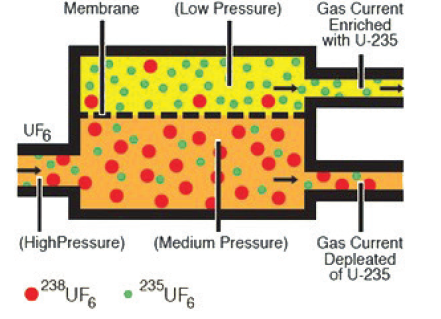
I. Ocorre redução da pressão do sistema naturalmente, pois na linha de entrada da mistura de gases, ocorre uma expansão na chegada a câmara de difusão em membrana.
II. A introdução de um sistema de vácuo na linha do U -235 enriquecido favorece a maior velocidade da separação dos componentes do sistema.
III. A difusão do composto contendo U-238 pela membrana é mais intensa, por isso é necessário reduzir a pressão do sistema garantindo assim a maior passagem pela membrana do composto contendo U – 235.
São verdadeiras as afirmações contidas na alternativa:
Um cilindro contém uma mistura de 88 g de CO2(g) com uma quantidade desconhecida de gás argônio foi mantido em determinadas condições de pressão e temperatura.
Depois de vários testes, descobriu-se que com a adição de 220g de CO2(g) à mistura, mantendo-se temperatura e pressão constantes, o volume dobra.
Assinale a alternativa que apresenta a quantidade de argônio existente na mistura.
Dados: Massa atômica: Ar=40u; C=12u; O=16u
Qual é a concentração de íons sódio, em mol/L, presentes em 10g de cloreto de sódio dissolvidos em 50mL de água?
(Considere: MMNa=23g/mol, MMCI=35g/mol)
Considere a reação entre o ácido sulfúrico e o hidróxido de sódio e assinale a alternativa que apresenta a soma dos índices m, n, o e p.
mH2SO4(aq) + nNaOH(aq) oNas2SO4(s) + pH20(l)
[H2]=1,83x10-3 mol/L, [l2]= 3, 12x10-3 mol/L e [HI]= 17,67 X 10-3 mol/L. 2 HI(g)
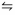 H2(g) + I2(g)
H2(g) + I2(g)(_88^226)Ra-> (_86^222)Rn+(_2^4)α
Analise as seguintes moléculas e assinale a alternativa que as classifica, de acordo com a sua função orgânica.
I. CH3OH
II. CH2CH2
III. CH3CH2OCH2CH3
Considere as seguintes reações para células eletroquímicas e assinale a alternativa correta.
1. Cu2+ + Zn0 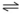 Cu0 + Zn2+ E= 1,1V
Cu0 + Zn2+ E= 1,1V
2. Cu0 + Zn 2+ 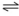 Cu2+ + Zn0 E= -1,1V
Cu2+ + Zn0 E= -1,1V
Dado: MMetilenoglicol= 62g;mol
O Ca(OH)2 é ____________, ou seja, em solução aquosa está ____________.