Questões de Concurso
Foram encontradas 9.182 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Na + H2O → NaOH + H2
No balanceamento dessa reação, tem-se molécula(s) de sódio e de água que resulta(m) em hidróxido de sódio e hidrogênio molecular na respectiva proporção de
N2 + H2 → NH3
Após o balanceamento da reação, qual será o volume de amônia produzido, sabendo que 1 mol de gás produz volume de 22,4 L?
A respiração aeróbica é o processo de produção de energia por meio de carboidratos, conforme a seguinte reação:
C6H12O6 + 6 O2 + 6 H2O → 6 CO2 + 12 H2O
No consumo de duas moléculas de carboidrato, quantos mols de gás carbônico são liberados?
Observe a reação.
Fe2O3 + CO → Fe + CO2
Considerando essa reação não balanceada, quantos gramas de óxido de ferro (Fe2O3) são necessários para a produção de 4 mols de ferro (Fe) em uma reação balanceada?
Dados:
Massa molecular (Fe2O3) = 160 g/mol;
massa molecular (Fe) = 56 g/mol
As reações a seguir representam o sistema de tamponamento sanguíneo do bicarbonato.
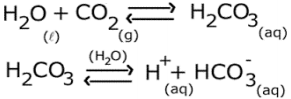
De acordo com as reações, o aumento de CO2 no sangue
resulta em
Observe a reação:
2H2O → 2H2 + O2
Essa reação da água em corrente elétrica é caracterizada
por ser uma reação de