Questões de Concurso
Foram encontradas 8.706 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Considerando as informações da figura, pode-se afirmar corretamente que:
As características químicas da água ocorrem em função da presença de substâncias dissolvidas, geralmente mensuráveis apenas por meios analíticos.
Relacione a COLUNA II com a COLUNA I associando os indicadores químicos das águas às suas propriedades.
COLUNA I
1. Dureza
2. Alcalinidade
3. Corrosividade
4. Salinidade
COLUNA II
( ) Indicador caracterizado pela presença de ácidos minerais ou soluções de oxigênio que atuam sobre os metais.
( ) Característica conferida à água pela presença de sais de metais alcalino-terrosos e alguns outros metais em menor quantidade.
( ) Presença na água de substâncias como bicarbonatos, cloretos e sulfatos, conferindo a ela um sabor característico.
( ) Característica decorrente da presença de bicarbonatos, carbonatos e hidróxidos, quase sempre de metais alcalinos ou alcalino-terrosos.
Assinale a sequência correta.
Considere que um estudante misturou 20 mL de uma solução aquosa de HCl 1,0 mol/L com 20 mL de uma solução aquosa de NaOH 1,0 mol/L em um calorímetro. A temperatura da mistura reacional aumentou de 20 ºC para 28 ºC.
Partindo do princípio que a perda de calor da mistura reacional para o ambiente é desprezível e que o volume total da mistura é 40 mL, é correto afirmar que a variação da entalpia da reação é mais próxima de
Dados:
Calor específico (c) do meio reacional é igual a 4,18 J/g K.
Densidade (d) da mistura é igual a 1,0 g/mL.
O termo cromatografia é difícil de ser definido rigorosamente porque o nome tem sido aplicado a diversos sistemas e técnicas. Todos esses métodos, contudo, apresentam em comum o uso de uma fase estacionária e de uma fase móvel. A cromatografia gasosa é uma das técnicas mais empregadas em análises qualitativas e quantitativas. Sobre a cromatografia gasosa, assinale com V as afirmativas verdadeiras e com F as falsas.
( ) A cromatografia gás–líquido é baseada na partição do analito entre a fase móvel gasosa e uma fase líquida imobilizada na superfície de um material sólido inerte de recheio ou nas paredes de um tubo capilar.
( ) A fase móvel em cromatografia gasosa é denominada gás de arraste e deve ser quimicamente reativa com o analito de interesse.
( ) O sistema de configuração de colunas é composto por seringas calibradas empregadas para configurar o fluxo de gás de arraste e substâncias imóveis.
( ) Nas separações cromatográficas gasosas, dezenas de detectores podem ser empregados, mas o detector de ionização em chama (DIC) é o mais empregado em aplicações da cromatografia gasosa em geral.
Assinale a sequência correta.
A lei de absorção, também conhecida como Lei de Beer, diz quantitativamente como a grandeza da atenuação depende da concentração das moléculas absorventes e da extensão do caminho sobre o qual ocorre a absorção. A transmitância T da solução é a fração da radiação incidente transmitida pela solução.
Considerando que um feixe de radiação, ao passar por uma solução absorvente, registrou uma absorbância X, é correto afirmar que a transmitância será igual a
Considere que em uma amostra de água fluvial foi analisada a concentração de Fe+2 por meio da titulação redox. Para isso retirou-se uma alíquota de 50 mL da amostra da água, que foi titulada com uma solução-padrão de KMnO4 0,10 mol/L em meio ácido.
Se 20 mL da solução de permanganato são necessários para atingir o ponto final da titulação, a concentração de íon ferro (II), em mol/L, na água fluvial, é igual a
Na área de estudo da potenciometria, sabe-se que o eletrodo indicador é um dispositivo que, imerso na solução contendo o analito, desenvolve um potencial, que depende da atividade do analito. A maioria dos eletrodos indicadores empregados na potenciometria é seletiva em sua resposta.
Um eletrodo que é classificado como eletrodo indicador é o
Analise a situação a seguir.
Em um preparo de 100 mL de uma solução de ácido clorídrico (HCl) 0,1 mol/L, um técnico retirou da solução estoque 1 mL e completou com água até a linha de aferição.
Considerando que a densidade da solução estoque era 1,1 g/mL, qual a porcentagem aproximada em massa do ácido que estava contida no estoque?
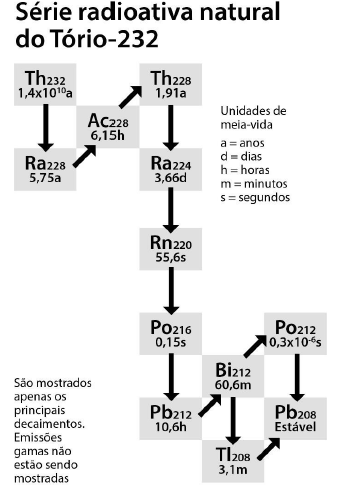
Uma série natural de decaimento radioativo começa com uma espécie radioativa que, ao emitir radiações alfa, beta e / ou gama, forma uma espécie mais estável.
Considere que um mol de um elemento radiativo emitiu sete mols de partículas alfa e quatro mols de partículas beta produzindo um mol de um elemento mais estável.
Nesse contexto, qual processo reacional nuclear pode representar esse decaimento radioativo?
As propriedades das substâncias aumentam sua magnitude de acordo com os tipos de interações entre moléculas predominantes.
Nesse sentido, é correto afirmar que as forças intermoleculares são fortes quando se têm menores
Os métodos potenciométricos de análises se baseiam na medida do potencial de células eletroquímicas, sem o consumo apreciável de corrente. Há cerca de um século, as técnicas potenciométricas têm sido utilizadas para localizar o ponto final em titulações.
Considere que em uma titulação potenciométrica de 10 mL de ácido clorídrico (HCl), a partir de um padrão de NaOH 0,10 mol/L, os resultados experimentais foram estimados utilizando o método da primeira derivada, conforme descrito no gráfico a seguir.
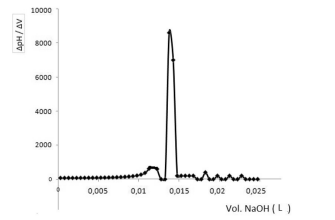
Nesse contexto, a concentração de ácido clorídrico em
mol/L titulado por hidróxido de sódio é igual a
Considerada como técnica analítica bem-sucedida, a espectrometria de absorção atômica é uma das mais utilizadas na determinação de elementos em baixas concentrações, que estão presentes em uma variedade de amostras, líquidas, sólidas, em suspensão ou até mesmo gasosas.
Sobre a técnica de espectrometria de absorção atômica, assinale com V as afirmativas verdadeiras e com F as falsas.
( ) A técnica de absorção atômica pode ser aplicada para quantificar vários elementos ao mesmo tempo.
( ) Instrumentos de absorção atômica utilizam um plasma de alta temperatura para atomização e excitação da amostra.
( ) A determinação de espécies atômicas somente é feita em meio gasoso, no qual os átomos individuais ou íons elementares se encontram bem espaçados uns dos outros.
( ) As análises quantitativas pela técnica de absorção atômica são baseadas em calibração com padrões externos e não devem ser fundamentadas na medida de um único padrão, presumindo que a Lei de Beer esteja sendo obedecida.
Assinale a sequência correta.
A Aspirina, como é conhecida o ácido acetilsalicílico (C9H8O4), é um fármaco que apresenta propriedades antitérmicas, anti-inflamatórias e analgésicas. Esse fármaco pode ser sintetizado pela reação entre o ácido salicílico (C7H6O3) e o anidrido acético (C4H6O3), catalisada por um ácido.
A equação a seguir representa o processo de síntese da aspirina.
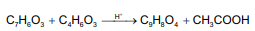
Considere, hipoteticamente, que 3 g de ácido salicílico foram misturados com 6 mL de uma solução de anidrido acético cuja densidade e grau de pureza são 1,2 g/mL e 80% m/m, respectivamente.
Se o rendimento da reação química é 100%, qual a
massa aproximada de aspirina produzida em gramas?
O eteno, buteno, propileno, poliestireno e poliacetato de vinila são exemplos de polímeros sintéticos.
O monômero que dá origem ao polietileno é o propeno.
As poliamidas são polímeros formados por condensação. Um exemplo de poliamida é o náilon.
Os polímeros podem ser formados através de reações de adição e de condensação.
O ponto estequiométrico, de equivalência ou final teórico de uma titulação é aquele calculado com base na estequiometria da reação envolvida na titulação.
Na técnica de volumetria, a solução padrão é a solução cuja concentração é conhecida com exatidão e que estará sendo usada para comparação das concentrações.
Para realizar a técnica de volumetria, não deve haver um indicador que provoque mudanças de propriedades físicas como a cor.
