Questões de Concurso
Foram encontradas 9.182 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Leia o texto abaixo e responda às questões propostas.
O mundo daqui a cinco anos
Telemedicina, nanotecnologia, tecnologias 3D e tradução simultânea por reconhecimento de voz. Todos estes recursos, em maior ou menor escala, já foram absorvidos pela sociedade. Suas primeiras aparições foram na lista “Five to five” da IBM, que prevê cinco fenômenos que podem mudar nosso cotidiano a cada cinco anos. Ontem a multinacional divulgou o que acontecerá até 2018. E sua aposta é que, com o desenvolvimento tecnológico, tudo - do ensino acadêmico à hora de ir para o trabalho - pode ser personalizado.
A transformação mais radical pode ser na medicina, área em que algumas empresas pretendem fornecer aos médicos o mapeamento genético de cada paciente. A tecnologia fará do teste do DNA, hoje ainda raro, o principal meio para a decisão da terapia adequada. Com isso, será possível optar por tratamentos personalizados para males como doenças cardiovasculares.
Na escola, o professor terá reforço para lidar com o método como cada aluno consegue aprender. “A computação cognitiva ajudará a calcular como cada aluno aprende e cria um sistema flexível, que se adapta continuamente ao estudante”, revela a IBM.
Com base no tempo e no engarrafamento, o smartphone poderá recomendar a seu usuário que saia de casa alguns minutos mais cedo - e, também, que caminho deve seguir.
O deslocamento fica mais fácil, mas o comércio da vizinhança também atrairá as pessoas. A lojinha da esquina, agora conectada a seu telefone, divulgará as promoções e conhecerá suas preferências: “Será a fusão do que há de melhor na loja física - tocar e vestir um produto - com a riqueza de informações - as ofertas instantâneas e o gosto do consumidor".
Na web, aliás, a invasão de contas de emails e a ação de hackers esbarrarão na “polícia pessoal online”. Portais como o Google já avisam o usuário quando suas mensagens são lidas fora de locais onde o dono da conta costuma acessar a internet - um outro país, por exemplo. Todos os passos são monitorados. Segundo a IBM, com a “permissão” do usuário. Mas, depois da revelação da vigilância mundial da NSA, este avanço tecnológico pode deixar muita gente ressabiada.
(O Globo - Caderno Ciência - 19/12/2013, p. 45.)
" ... a invasão de contas de emails e a ação de hackers esbarrarão na 'polícia pessoal online'."(§ 6)
Na oração de sujeito composto acima transcrita, a concordância do verbo foi feita com os dois núcleos, no plural. Das sentenças abaixo, aquela em que a concordância é facultativa, podendo-se flexionar o verbo no singular ou no plural, é:
Alguns cuidados devem ser tomados ao guardar os reagentes em laboratório. Deve-se ter conhecimento de quais substâncias são incompatíveis entre si, para evitar seu contato e possíveis acidentes, como explosões e liberação de produtos tóxicos inflamáveis. Um exemplo é o nitrato de prata; essa substância é incompatível com quais substâncias químicas a seguir?
O ponto de fusão
O telúrio(te) é um
O (a) ______________ é um ácido tóxico e corrosivo, utilizado na produção de fertilizantes e de compostos orgânicos.
Marque a alternativa que responde corretamente a lacuna acima.
Um diagrama completo utilizado para identificar os graus de toxicidade, inflamabilidade, reatividade e riscos específicos de produtos químicos é o diagrama de Hommel (figura abaixo). Esse diagrama tem o formato de um losango e é formado pela junção de 4 losangos de cores diferentes (1- branco, 2- azul, 3- vermelho, 4- amarelo), que correspondem a características diferentes das substâncias químicas. A opção que corresponde ao significado que cada cor representa na sequência mencionada é:
No estudo da cinética química postula-se a seguinte afirmação: “ A velocidade de uma reação química quando a temperatura é mantida constante é proporcional ao produto das concentrações das espécies reagentes.” Essa afirmação é conhecida como:
A microscopia eletrônica de varredura é uma técnica de análise importante na caracterização de materiais cerâmicos, metálicos e poliméricos, com uso em várias indústrias como a aeroespacial, automobilística e de biomateriais. Com base nos princípios da microscopia eletrônica de varredura assinale a alternativa correta.
A espectroscopia de absorção na região do UV/Vis é uma técnica de caracterização que se baseia na absorção da radiação eletromagnética nas regiões visível e ultravioleta do espectro. Com base nas características e particularidades dessa espectroscopia assinale a alternativa correta.
O processo de deionização da água consiste em:
Sobre a propriedade da matéria, considere as afirmativas abaixo.
I - matéria é tudo o que tem massa e ocupa lugar no espaço;
II - o volume de uma porção de matéria expressa o quanto de espaço é ocupado por ela;
III - mudanças de estado físico não provocam mudanças na densidade de uma substância;
IV - a densidade de um objeto ou de uma amostra de certo material ou substância é o resultado da divisão do número de mols pelo seu volume;
V - uma mistura em que a textura desigual dos materiais pode ser detectada é denominada mistura homogênea.
As alternativas corretas são:
Tendo em vista os fatores que influenciam a velocidade de uma reação química, assinale a alternativa INCORRETA:
A produção de sabão é realizada pela reação saponificação, consistindo em uma reação de óleo ou gorduras com uma base muito forte.
Fonte da imagem: https://alunosonline.uol.com.br
O que explica as características limpantes do sabão?
Um determinado sal X possui solubilidade conforme o gráfico abaixo.
Uma solução saturada de 340g à 50°C foi resfriada até 10°C. Quanto em gramas de soluto precipitará?
Assinale a alternativa que apresenta uma molécula apolar:
“Em 2 de julho de 1909, Fritz Haber (1868-1934) e seu assistente Robert Le Rossignol (1884-1976), em um laboratório da Universidade Técnica de Karlsruhe, demonstraram a Alwin Mittasch (1869-1953) e Julius Kranz, ambos da BASF (Badische Anilin und SodaFabrik), seu processo de produzir amônia (NH3) a partir de hidrogênio e nitrogênio, utilizando ósmio como catalisador. A importância deste evento, seja do ponto de vista científico, técnico, social etc. é enorme.”
Quim. Nova, Vol. 30, No. 1, 240-247, 2007
Assinale a alternativa que apresenta corretamente a geometria molecular da amônia (NH3):
A imagem abaixo mostra um processo muito importante realizado em países com escassez de água.
Fonte : https://xflow.pentair.com/pt-pt/spectrum/
Assinale a alternativa que apresenta o processo mostrado na imagem:
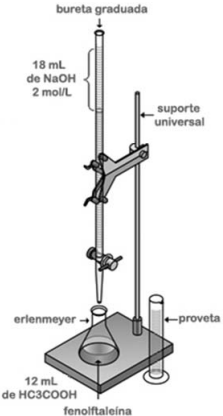
Tendo como referência a figura precedente, que representa uma titulação volumétrica, julgue o próximo item.
Se, na titulação, o ponto de virada ocorreu quando foram
consumidos 18 mL de NaOH, então a concentração da
solução de CH3COOH é igual a 1 mol/L.

Tendo como referência a figura precedente, que representa uma titulação volumétrica, julgue o próximo item.
A fenolftaleína é um indicador de pH empregado na
determinação do ponto de equivalência durante a titulação.

Tendo como referência a figura precedente, que representa uma titulação volumétrica, julgue o próximo item.
A reação de neutralização que ocorre na titulação em questão é corretamente representada pela equação química a seguir, devidamente balanceada.
CH3COOH(aq) + NaOH(aq) → NaC2H3O2(aq) + 2 H2O(ℓ)