Questões de Concurso
Foram encontradas 8.706 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
A reação mostrada abaixo é classificada como:
CaC03 → CaO + C02
Considerando a reação química mostrada abaixo:

A fórmula química do composto desconhecido (X)
corresponde a:
I. Cristal de cloreto de sódio II. Água pura III. Acetona IV. n-butano V. Cloreto de sódio dissolvido em água
Agora assinale a alternativa que corresponde correta e respectivamente, à ordem crescente de força de interação das substâncias elencadas de I a V, anteriormente:
I. Calcule o trabalho quando o gás passa de A para C, através de um processo de um estágio. II. Idem em 2 estágios, passando pelo ponto B. III. Idem em infinitos estágios. IV. Calcule o trabalho quando o gás passa de C para A, através de um processo de um estágio. V. Idem em infinitos estágios.
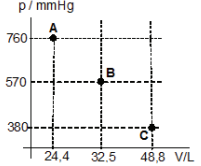 Dados:
1 pascal (1 Pa) = 1 N/m²
1 atmosfera (atm) = 1,013×105
N/m2
= 101,3 kPa
1 atm = 760 mmHg
1 torr = 1 mmHg = 133,3 Pa
1 atm.l = 101,3 J
Dados:
1 pascal (1 Pa) = 1 N/m²
1 atmosfera (atm) = 1,013×105
N/m2
= 101,3 kPa
1 atm = 760 mmHg
1 torr = 1 mmHg = 133,3 Pa
1 atm.l = 101,3 J A resposta correta para o conjunto de questões de I a V, respectivamente, é:
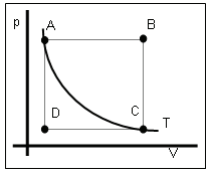 Identifique as transformações representadas por
A→B, B→C, C→D, D→A e A→C e assinale a alternativa
correta:
Identifique as transformações representadas por
A→B, B→C, C→D, D→A e A→C e assinale a alternativa
correta:Dado: 1 cal = ~4,187 J
Após analisar as afirmativas de I a V, assinale a alternativa correta:
 Assinale a alternativa que corresponde aos números de
oxidação na ordem em que aparecem no quadro:
Assinale a alternativa que corresponde aos números de
oxidação na ordem em que aparecem no quadro:Assinale a alternativa que corresponde aos balanceamentos corretos das equações de I a V, considerando somente os mínimos números inteiros:
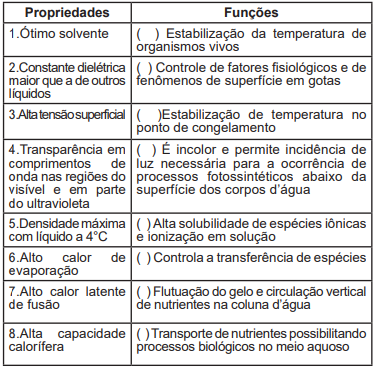
Assinale a alternativa que corresponde à ordem correta das correlações das propriedades com as funções, de cima para baixo segundo o que foi preenchido no quadro anterior:
I. Segundo a teoria de Brønsted-Lowry, o íon bicarbonato na Reação 1 é um ácido. II. Segundo a teoria de Lewis, a amônia na Reação 2 é uma base, pois ela doa elétrons. III. Segundo a teoria de Lewis, o íon bicarbonato na Reação 1 é anfótero. IV. Segundo Brønsted-Lowry, o íon carbonato na Reação 1 é uma base, chamada de base conjugada do íon bicarbonato. V. Todas as bases de Brønsted-Lowry mostradas nas equações são também consideradas bases de Lewis.
Assinale a alternativa correta:
I. As reações não vão até o fim. Elas continuam até que a composição da mistura reacional corresponda ao mínimo de entalpia. Essa composição é descrita por uma constante de equilíbrio característica da reação que depende da temperatura, dentre outros fatores. II. Para controlar o rendimento de uma reação, precisamos entender a base termodinâmica do equilíbrio e como a posição atual de equilíbrio é afetada por condições como a temperatura e a pressão, por exemplo. III. O equilíbrio químico é o estágio da reação química em que não existe mais tendência a mudar a composição da mistura da reação, isto é, as concentrações ou pressões parciais dos reagentes e produtos. Como os equilíbrios físicos, todos os equilíbrios químicos são dinâmicos, com a reação direta e inversa ocorrendo com a mesma velocidade. IV. A termodinâmica descreve quantitativamente o equilíbrio, o que nos possibilita controlar a direção e o rendimento das reações. V. A composição de uma mistura de reação no equilíbrio é descrita pela constante de equilíbrio, que é dependente do produto das atividades dos produtos (elevadas a potências iguais aos coeficientes estequiométricos da equação química balanceada da reação) dividido pelo produto das atividades dos reagentes (elevadas a potências iguais a seus coeficientes estequiométricos).
Assinale a alternativa correta: