Questões de Concurso
Foram encontradas 8.706 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Assinale a alternativa correta:
Assinale a alternativa correta:
Assinale a alternativa correta:
I. São favorecidas por solventes polares próticos. II. Podem resultar em misturas de isômeros ópticos. III. Podem apresentar como produtos secundário alcenos. IV. Podem ser mono ou bimoleculares. V. Podem apresentar rearranjos.
Assinale a alternativa correta:
Assinale a alternativa correta:
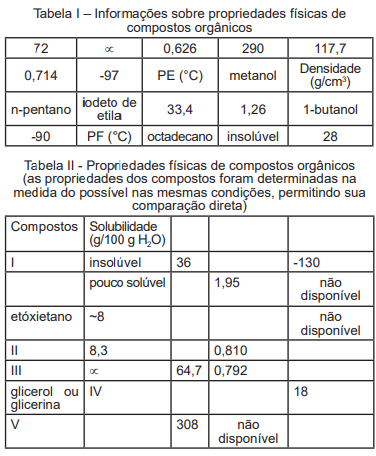 I. Sabendo-se que o composto I tem densidade de
0,626 g/cm3
, a menor densidade da lista de compostos
apresentados, ele certamente representa o n-pentano,
pois tal composto possui também baixo ponto de
ebulição e é insolúvel em água.
II. O composto II representa o n-butanol e seu ponto de
fusão é -97°C.
III. O composto III representa o metanol e sua mais alta
solubilidade em relação ao n-butanol está relacionada a
sua maior interação por ligação de hidrogênio, já que a
molécula é menor.
IV. A glicerina ou glicerol (também conhecida como 1, 2, 3-
propanotriol) tem ponto de ebulição muito alto, 290°C,
devido aos grupos hidroxila, mesmo motivo que deixa
este composto extremamente solúvel em água. Assim
sendo, IV representa o símbolo do infinito.
V. O composto V é sólido à temperatura ambiente de 25°C. Assinale a alternativa correta:
I. Sabendo-se que o composto I tem densidade de
0,626 g/cm3
, a menor densidade da lista de compostos
apresentados, ele certamente representa o n-pentano,
pois tal composto possui também baixo ponto de
ebulição e é insolúvel em água.
II. O composto II representa o n-butanol e seu ponto de
fusão é -97°C.
III. O composto III representa o metanol e sua mais alta
solubilidade em relação ao n-butanol está relacionada a
sua maior interação por ligação de hidrogênio, já que a
molécula é menor.
IV. A glicerina ou glicerol (também conhecida como 1, 2, 3-
propanotriol) tem ponto de ebulição muito alto, 290°C,
devido aos grupos hidroxila, mesmo motivo que deixa
este composto extremamente solúvel em água. Assim
sendo, IV representa o símbolo do infinito.
V. O composto V é sólido à temperatura ambiente de 25°C. Assinale a alternativa correta: *Grupo farmacofórico é o conjunto de características eletrônicas e estéricas que caracterizam um ou mais grupos funcionais ou subunidades estruturais, necessários ao melhor reconhecimento molecular pelo receptor e, portanto, para o efeito farmacológico desejado
Assinale a alternativa correta:
Considere a tabela abaixo para responder a questão 38.
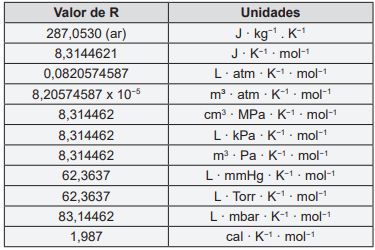
Massas atômicas (u): C = 12,01, O = 16,00, H = 1,01
Analise as seguintes afirmativas e a seguir assinale a alternativa correta:
I. Um tanque de oxigênio armazenado fora de um edifício tem uma pressão de 20,00 atm às 6:00 h da manhã, quando a temperatura está em torno de 10°C. A pressão no tanque às 18:00 h quando a temperatura chega a 30°C é 21,41 atm.
II. Um motor de automóvel mal ajustado pode liberar, em marcha lenta, até 1,00 mol de monóxido de carbono por minuto. A 27°C, o volume desse gás, a 1 atm de pressão que pode ser liberado por minuto é 24,61 L.
III. O óleo produzido a partir de folhas de eucalipto contém o composto volátil eucaliptol. Esse composto tem densidade 0,320 g L-1 a 190°C e 60,0 mmHg. A massa molar do eucaliptol gasoso é 153,89 g mol-1.
IV. O volume de gás carbônico (a 25°C e 1 atm) necessário para que uma planta produza 1,00 g de glicose (C6H12O6) por fotossíntese é 815 mL.
V. A composição do ar seco, em volume, é: 78% de nitrogênio, 21% de oxigênio e 1% de argônio. As pressões parciais desses gases no ar a uma pressão atmosférica de 1 atm são respectivamente, p(N2) = 0,78 atm, p(O2) = 0,21 atm e p(Ar) = 0,01 atm.
Assinale a alternativa correta:
Utilize os dados abaixo para responder a questão 37.

Escreva as semi-reações de cátodo e ânodo e a equação balanceada para os sistemas representados a seguir. Em cada caso faça um esquema da célula galvânica, calcule o valor de ΔE° e determine se corresponde a uma pilha ou eletrólise. Na sequência, assinale a alternativa correta.
Sistemas:
I. Pt(s) | Fe2+(aq), Fe3+(aq) | | Ag+(aq) | Ag(s)
II. Pt(s) | Cl- (aq) | Cl2(g) | | H+(aq) | H2(g) | C(gr)
III. V(s) | V2+(aq) | | U3+(aq) | U(s)
IV. Hg(l) | Cl- (aq) | Hg2Cl2(s) | | Sn4+(aq), Sn2+(aq) | Pt(s)
Assinale a alternativa correta:
:
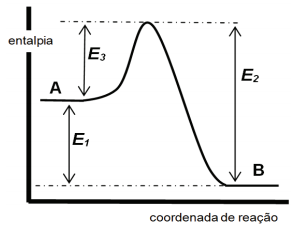 ( ) corresponde à entalpia da reação direta
( ) corresponde à energia de ativação da reação direta
( ) corresponde à entalpia da reação inversa
( ) corresponde à energia de ativação da reação inversa
( ) corresponde à entalpia da reação direta
( ) corresponde à energia de ativação da reação direta
( ) corresponde à entalpia da reação inversa
( ) corresponde à energia de ativação da reação inversa
Assinale a alternativa correta:
Assinale a alternativa correta:
Numere a coluna II de acordo com a coluna I, fazendo a relação entre as substâncias formadas pelos tipos de ligações químicas e suas características.

Assinale a sequência correta.