Questões de Concurso
Foram encontradas 8.706 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Considere os ácidos abaixo

Um estudante prepara soluções aquosas desses ácidos com a mesma concentração molar. Sobre esses ácidos e as
espécies presentes nas soluções, é correto afirmar que:
Considere a reação ácido-base de Lewis entre gás clorídrico e amônia:
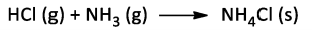
Considerando 100% de rendimento, calcule o volume mínimo da mistura equimolar dos reagentes, a 27ºC e 1 atm, de
modo que seja possível a obtenção de 10,7g do produto. Massas molares (g/mol): H = 1; N = 14; Cl = 35,5.
Quando, no estado gasoso, um átomo neutro de cloro absorve energia e perde um elétron, ocorre a formação de íon Cl+(g) de acordo com a equação abaixo:

A energia absorvida é definida como:
Observe abaixo a representação do equilíbrio e da curva de solubilidade (em pmol/L) de um sal hipotético XY:
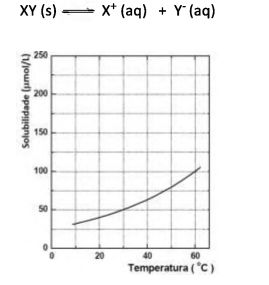
Qual é a constante do equilíbrio de solubilidade (Kps) do sal XY em 60 ºC?
Os dados da literatura científica mostram que K = 54, em 700 K, para a reação:

Considere uma mistura de hidrogênio, iodo e gás iodídrico em 700 K, cujas pressões parciais dos gases sejam 10 bar, 8
bar e 1 bar, respectivamente. Sobre essa mistura reacional e os valores do quociente de reação (Q) e da constante de
equilíbrio (K), é correto afirmar que:
O etano forma dois radicais metila, em 700 ºC, na seguinte reação de decomposição:
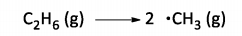
O estudo cinético desta decomposição forneceu dados que permitiram a obtenção dos gráficos abaixo:
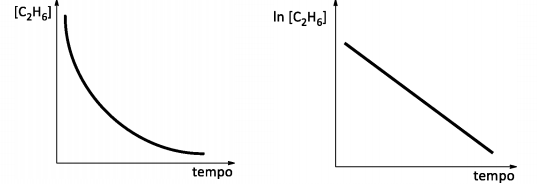
Com base nos gráficos apresentados e considerando k a constante de velocidade da reação, é correto afirmar que a lei
de velocidade da decomposição de etano para formação de radicais metila é:
Os oceanos possuem a capacidade de absorver certas quantidades de CO2 atmosférico através dos equilíbrios que
formam o denominado sistema carbonato:
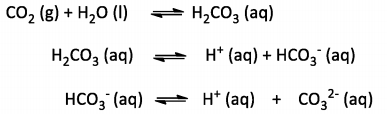
A concentração de cada espécie do sistema carbonato varia, dependendo do pH do meio. Considerando um experimento
em laboratório que simula uma condição de extrema alcalinidade (pH = 14), a espécie do sistema carbonato em maior
concentração será
Quando o composto p-cloro-nitrobenzeno é tratado com excesso de amônia em condições apropriadas, ocorre a formação do composto p-amino-nitrobenzeno de acordo com a reação abaixo:
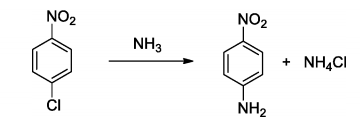
É correto afirmar que esta reação é um exemplo de:
A figura abaixo mostra as curvas de pressão de vapor versus temperatura de quatro líquidos. Um deles é a água e os
outros são os compostos orgânicos éter dietílico, etilenoglicol e etanol (não necessariamente nessa ordem):
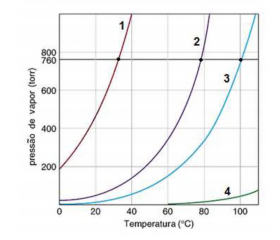
Considerando os líquidos mencionados e o gráfico apresentado, indique a alternativa incorreta.
Considere o composto c/s-1-cloro-4-t-butil-cicloexano, cuja estrutura é mostrada abaixo:
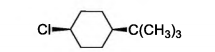
Indique a alternativa que mostra esta molécula em sua conformação mais estável.
O composto abaixo é derivado sintético de um produto natural marinho. Possui atividade antitumoral e já está em fase de
testes para tumores de pulmão e mama.
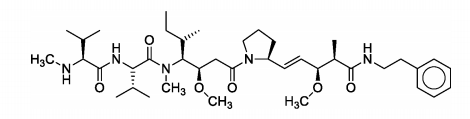
Considerando a fórmula estrutural apresentada, é incorreto afirmar que a molécula possui:
Para determinar a pureza de uma amostra de 500,0 mg de Na2B4O7(s), um técnico realizou uma titulação com solução de HCl 0,020 M. A reação é:
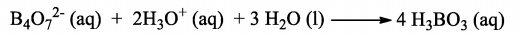
Sabendo que o volume utilizado da solução ácida foi 200,0 mL, é correto afirmar que a pureza da amostra em termos percentuais é:
Massas molares (g/mol): H = 1; B = 11; O = 16; Na = 23; Cl = 35,5.
A decomposição do oxalato de cálcio hidratado foi estudada utilizando-se análise termo gravimétrica em recipiente aberto. Sabe-se que, com o aquecimento, sucessivas decomposições ocorrem, de acordo com as equações abaixo:
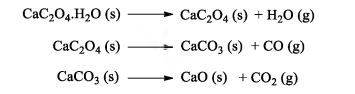
A curva de decomposição térmica esperada para esta análise é:
Um estudante se esqueceu de anotar no caderno qual foi o solvente utilizado em uma reação. Ao conversar com seu professor, ele explicou que estava na dúvida entre hexano, acetato de etila, etanol, éter dietílico e tolueno, que eram os solventes disponíveis no laboratório no dia do experimento. Ele relatou também que tinha separado uma pequena amostra do solvente. O professor respondeu que seria fácil tirar a dúvida e levou a amostra para uma análise de espectroscopia de infravermelho, chegando ao seguinte espectro:
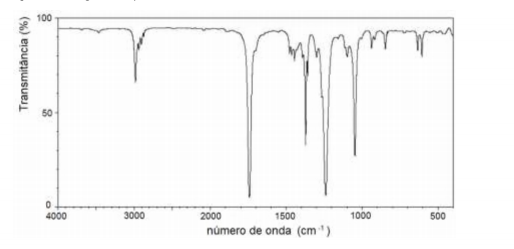
A partir do espectro obtido, pode-se afirmar que o solvente utilizado pelo estudante foi
Na padronização de uma solução de Ba(OH)2, utilizou-se 0,61 g do padrão primário ácido benzoico (C6H5COOH). O ponto final foi observado após a adição de 250,0 mL da solução básica. É correto afirmar que a concentração molar de Ba(OH)2 na solução é:
Massas molares (g/mol): H = 1, C = 12, O = 16 e Ba = 137.