Questões de Concurso
Foram encontradas 9.182 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
O interesse pelo gás natural está diretamente relacionado à busca de alternativas ao petróleo e de fontes menos agressivas ao meio ambiente. Este comportamento resultou na intensificação das atividades de prospecção e exploração, particularmente entre os países em desenvolvimento. O resultado foi não só o aumento do volume, mas também a expansão geográfica das reservas provadas (são reservas cujos reservatórios estão em produção ou os fluídos nele contidos têm sua existência e capacidade de produzir comprovadas por testes).
(ANEEL, Atlas de energia elétrica do Brasil. Capítulo 6 - Gás Natural, p. 94, acesso em abril de 2019).
Leia as assertivas abaixo e identifique quais estão corretas:
I. Pode-se afirmar que o gás natural é menos poluente que o petróleo.
II. Pode-se afirmar que o gás natural é uma alternativa ao petróleo.
III. O Brasil é um dos países em desenvolvimento que expandiu a área de gás natural nos últimos anos.
IV. A operação gasoduto Brasil/Bolívia deu início à expansão acelerada do consumo de gás natural no Brasil.
O gás natural transformou-se de sapo em príncipe na matriz energética mundial. No século XIX, nos Estados Unidos, era considerado um estorvo ao ser encontrado junto com o petróleo, pois exigia uma série de procedimentos de segurança que encareciam e complicavam as atividades de prospecção. No século XX, a partir dos anos 80, o consumo entrou em franca expansão e o gás natural transformou-se na fonte de energia de origem fóssil a registrar maior crescimento no mundo. Uma posição que detém até hoje e que deverá manter no médio prazo.
(ANEEL, Atlas de energia elétrica do Brasil. Capítulo 6 - Gás Natural, p. 93, acesso em abril de 2019).
Quanto ao gás natural, observe as assertivas abaixo.
I. O gás natural é um hidrocarboneto resultante da
decomposição da matéria inorgânica durante
milhões de anos.
II. O gás natural é encontrado no subsolo, em rochas porosas isoladas do meio ambiente por uma camada impermeável.
III. Em suas primeiras etapas de decomposição, esta matéria orgânica de origem animal produz o petróleo. Em seus últimos estágios de degradação, o gás natural. Por isso, é comum a descoberta do gás natural tanto associado ao petróleo quanto em campos isolados.
IV. Assim como ocorre no petróleo, a composição básica do gás natural são as moléculas de hidrocarbonetos encontradas em estado volátil e de baixa densidade.
A alternativa correta: é:
Segundo as normas técnicas referentes ao sistema de transmissão e distribuição de gás combustível, ABNT NBR 12.712, identifique a resposta correta:
I. Gás combustível é toda forma gasosa apropriada para uso como combustível doméstico, comercial ou industrial, sendo transmitida (transportada) ou distribuída para o usuário através de dutos.
II. A transmissão do gás (transporte) refere-se à atividade de transferência de gás combustível, por meio de dutos, desde as fontes de produção ou suprimento até os locais em que o produto passa para o sistema de distribuição de gás.
III. A distribuição de gás refere-se à atividade de fornecimento de gás combustível, por meio de dutos, aos estabelecimentos consumidores (residenciais, comerciais, industriais, outros) através de rede da companhia distribuidora.
IV. Gasoduto é uma tubulação destinada à transmissão e distribuição de gás.
A alternativa correta é:
Na determinação dos praguicidas A e B em uma amostra, utilizou-se um sistema de cromatografia líquida de alta-eficiência (CLAE). Esse sistema é composto por uma coluna de fase reversa de 0,46 mm x 15 cm, eluída a 1,0 mL/min a 400 C com a utilização de acetonitrila 35% v/v, sendo a absorbância no UV medida a 254 nm. O cromatograma obtido está apresentado ao lado.
Considerando que a resolução foi de 7,2; o tempo de retenção relativa (α) foi de 3,8; o fator de capacidade (k’) para o composto B foi de 3,5 e o tempo morto (tm) foi de 1,2 min, os valores de t1, t2, e wmédio, são, respectivamente,
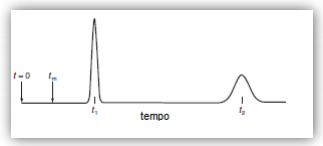
A figura abaixo representa o cromatograma de uma mistura contendo as substâncias A, B e C. Os tempos de eluição dessas substâncias são 15 min, 40 mim e 60 min, respectivamente.
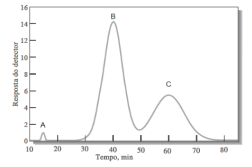
Com base nessa figura, a opção que apresenta a retenção relativa entre as substâncias C e B
e o pico correspondente ao metanol é
A figura abaixo mostra os pictogramas utilizados para a classificação dos resíduos perigosos frequentemente gerados em laboratórios.
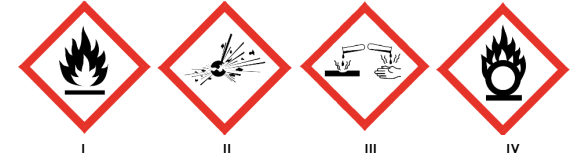
A opção que representa corretamente cada um dos pictogramas é:
A espectrometria de absorção atômica é o método mais utilizado para a determinação de elementos individuais em diversos tipos de amostras. Com relação aos atomizadores, considere as afirmativas abaixo.
I Em um atomizador por chama, uma amostra sólida é nebulizada por um fluxo de oxidante gasoso, misturado com um combustível também gasoso e levado à chama, onde ocorre a atomização.
II Para atingir a máxima sensibilidade analítica, a chama necessita ser ajustada, movendo-a para cima e para baixo em relação ao feixe de radiação até que a região de absorbância máxima seja localizada.
III Nos atomizadores eletrotérmicos, alguns poucos microlitros de amostra são inseridos em um tubo de grafite eletricamente aquecido para que ocorra a secagem, a pirólise, a atomização seguida da limpeza e uma rampa de resfriamento.
IV Na maioria dos métodos baseados em atomizadores eletrotérmicos, as amostras são introduzidas na forma de soluções, não sendo possível fazer a análise direta de sólidos.
Das afirmativas, estão corretas
A padronização do permanganato de potássio foi realizada utilizando-se o padrão primário oxalato de sódio e a titulação espectrofotométrica conforme a seguinte reação:
2KMnO4(aq) + 8H2SO4(aq) + 5Na2C2O4(aq) → 5Na2SO4(aq) + K2SO4(aq) + 2MnSO4(aq) + 10CO2(g) + 8 H2O(l)
Pesou-se 0,1985g de oxalato de sódio diluindo-o em 50 mL de solução de ácido sulfúrico pH 2,5. Em seguida, monitorou-se a absorbância em λ = 545 nm registrando-se os seus valores em função do volume de KMnO4 adicionado.
Sabendo-se que a única espécie que absorve a luz, nesse comprimento de onda, é o
permanganato de potássio, o perfil característico dessa titulação está em
Dentre os diversos métodos de calibração utilizados nas determinações analíticas , o método do padrão interno, quando empregado adequadamente, pode compensar diversos tipos de erros, quer sejam estes aleatórios ou sistemáticos. Tendo como base esse método de calibração, considere as afirmativas abaixo.
I Um padrão interno é uma substância que é adicionada em quantidade constante na amostra, no branco e nos padrões de calibração de uma análise.
II Para escolha do padrão interno, este deve apresentar propriedades físicas e químicas diferentes do analito.
III Se o padrão interno não for tomado como um constituinte principal na amostra, es te não deve estar presente na matriz da amostra, de forma que a única fonte desse padrão seja a quantidade adicionada.
IV Se, durante as etapas de preparação da amostra, que antecedem à análise, ocorrer uma perda de amostra, o uso de padrão interno não é recomendado.
Das afirmativas, estão corretas
Considere a figura abaixo que apresenta a curva de calibração obtida para a determinação de DQO pela técnica de espectrofotometria utilizando dicromato de potássio em meio ácido, bem como a equação da reta.
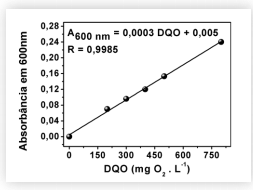
Em uma indústria de processamento de castanha de caju, coletou-se uma amostra de
efluente de 100,0 mL para análise de DQO. Após o tratamento apropriado da amostra com
dicromato de potássio em meio ácido, mediu-se a sua absorbância em 600 nm e obteve-se
um valor de 0,138. Nessa amostra, o valor de DQO em mg O2 L
-1
é