Questões de Concurso
Foram encontradas 8.725 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Considere as informações a seguir para responder à questão.
A titulação é uma técnica de determinação da concentração de um soluto e é empregada com frequência em laboratórios forenses. Na seguinte figura, é apresentada uma curva de titulação e o ponto P indica o ponto de equivalência ou de inflexão da curva de titulação que se dá com a adição de 20 mL de uma solução básica.

Vários indicadores podem ser úteis para indicar o ponto de viragem durante a titulação. A tabela a seguir apresenta alguns indicadores e sua faixa de transição:

Considere o texto e a figura a seguir para responder à questão.
Um quarto de quilograma de uma amostra de matéria desconhecida, inicialmente no estado sólido a 35°C, é aquecido à taxa de 150 calorias por minuto, e a variação de temperatura foi acompanhada conforme apresentado no gráfico da figura a seguir:

Considere o texto e a figura a seguir para responder à questão.
Um quarto de quilograma de uma amostra de matéria desconhecida, inicialmente no estado sólido a 35°C, é aquecido à taxa de 150 calorias por minuto, e a variação de temperatura foi acompanhada conforme apresentado no gráfico da figura a seguir:

A ideia fundamental para o correto balanceamento de uma equação química de oxirredução é tornar o número de elétrons cedidos igual ao de elétrons recebidos na reação. Considere a reação de oxirredução entre o permanganato de potássio e o ácido clorídrico:
KMnO4 + HCI → KCl + MnCl2 + Cl2 + H2O
A soma dos menores números inteiros que fazem o correto balanceamento dessa reação é
igual a
Considere que o combustível empregado num veículo leve seja o etanol puro e que a reação de combustão desse combustível, no motor do veículo, seja completa. A tabela a seguir, apresenta informações acerca da energia, em termos de entalpia das ligações químicas.

ATKINS, P.; JONES, L. Chemical principles, the quest for insight. 6. ed. New York. P.300 (Adaptado).
Com bases nessas informações, a entalpia de combustão do etanol, em kj/mol é
aproximadamente igual a
Deseja-se preparar um litro de solução de ácido sulfúrico 0,1 mol/L a partir de uma amostra de ácido sulfúrico concentrado. Acerca do tema, Informe se é verdadeiro (V) ou falso (F) o que se afirma a seguir e assinale a alternativa com a sequência correta.
( ) No preparo de uma solução H2SO4 a partir do ácido concentrado, deve-se, primeiramente, colocara água destilada no balão volumétrico e, logo após, adicionar o ácido concentrado.
( ) Caso o frasco da solução contendo ácido sulfúrico 0,1 mol/L caia sobre a bancada do laboratório, pode-se fazer uso do bicarbonato de sódio para neutralização da solução derramada.
( ) O frasco de ácido sulfúrico concentrado pode ser armazenado, sem riscos, nos mesmos locais onde se encontram frascos de ácido acético.
Informe se é verdadeiro (V) ou falso (F) o que se afirma a seguir e assinale a alternativa com a sequência correta.
( ) O biodiesel pode ser preparado a partir da reação de transesterificação de gorduras e óleos vegetais ou animais.
( ) A glicerina é um subproduto do processo de produção de biodiesel e por apresentar a função orgânica álcool em sua estrutura, pode ser utilizada na indústria farmacêutica e alimentícia.
( ) A principal desvantagem do uso do biodiesel é a alta concentração de enxofre e, ainda, de compostos aromáticos em sua composição.
Considere as reações a seguir a 25°C e 1 atm.

Com base nessas informações e considerando que nas reações 2 e 3 o valor de ΔH é referente à reação balanceada com os menores números inteiros, determine o valor aproximado da entalpia da reação de hidrogenação do acetileno.
Observação: Para o cálculo do valor de ΔH da reação de hidrogenação do acetileno, esta deverá ser balanceada com os menores números inteiros que fazem o seu correto balanceamento.
Considere o texto a seguir para responder à questão.
A reação de ionização do ácido clorídrico, HCl(g) → H+(aq) + Cl-(aq) , processa-se a 25°C e 1 atm e são conhecidos os seguintes valores termodinâmicos ΔH = -75 kj/mol e ΔS = -131, 5 J/(mol. K).
Considere o texto a seguir para responder à questão.
A reação de ionização do ácido clorídrico, HCl(g) → H+(aq) + Cl-(aq) , processa-se a 25°C e 1 atm e são conhecidos os seguintes valores termodinâmicos ΔH = -75 kj/mol e ΔS = -131, 5 J/(mol. K).
Considere o texto a seguir para responder à questão.
A reação de ionização do ácido clorídrico, HCl(g) → H+(aq) + Cl-(aq) , processa-se a 25°C e 1 atm e são conhecidos os seguintes valores termodinâmicos ΔH = -75 kj/mol e ΔS = -131, 5 J/(mol. K).
Acerca da entropia da reação, analise as asserções a seguir:
O valor negativo de ΔS indica que um mol de H+(aq) mais um mol de Cl-(q) são menos desordenados que um mol de HCl gasoso separado do solvente água.
PORQUE
Os íons aquosos são mais desordenados que compostos no estado gasoso.
Referente às asserções, é correto afirmar que
O modelo para o átomo proposto por Rutherford está representado a seguir:
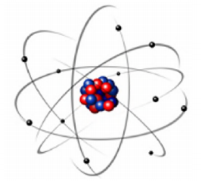
Com esse modelo, Rutherford interpretou
A acetanilida é uma amida secundária, que tem a mesma função do paracetamol, atuando como analgésico e antipirético. Pode ser sintetizada por meio de uma reação da anilina, como apresentado na reação a seguir:

Em um laboratório, a reação apresentada foi conduzida nas condições de temperatura e
pressão apropriadas, com a adição de 279 kg de anilina e 204 kg de anidrido acético, ambos
com pureza de 100%, em um reator. A reação alcançou rendimento de 80%.
A acetanilida é uma amida secundária, que tem a mesma função do paracetamol, atuando como analgésico e antipirético. Pode ser sintetizada por meio de uma reação da anilina, como apresentado na reação a seguir:

Em um laboratório, a reação apresentada foi conduzida nas condições de temperatura e
pressão apropriadas, com a adição de 279 kg de anilina e 204 kg de anidrido acético, ambos
com pureza de 100%, em um reator. A reação alcançou rendimento de 80%.
A acetanilida é uma amida secundária, que tem a mesma função do paracetamol, atuando como analgésico e antipirético. Pode ser sintetizada por meio de uma reação da anilina, como apresentado na reação a seguir:

Em um laboratório, a reação apresentada foi conduzida nas condições de temperatura e
pressão apropriadas, com a adição de 279 kg de anilina e 204 kg de anidrido acético, ambos
com pureza de 100%, em um reator. A reação alcançou rendimento de 80%.