Questões de Concurso
Foram encontradas 8.725 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Uma solução de álcool desinfetante foi preparada, a 20°C, com água e etanol, sendo que a quantidade desse último na mistura foi de 71,2% massa/massa. O valor aproximado da pressão de vapor da mistura, em mmHg, é
Dados
Pressão de vapor do etanol puro: 44 mmHg a 20°C
Pressão de vapor da água pura: 18 mmHg a 20°C
M (água) = 18,00 g mol-1
M (etanol) = 46 g mol-1
Uma solução ideal foi feita misturando 360,00 mL de água e 1 mol de um soluto não volátil, armazenando a mesma a 20°C.
O valor aproximado da pressão de vapor, em mmHg, da mistura é
Dados
Pressão de vapor da água pura: 18 mmHg a 20°C
Massa específica da água pura: 1,00 g mL-1
M (H2O) = 18,00 g mol-1
Um eletrodo é formado por um fio de prata recoberto com uma camada de AgBr(s). A reação de redução característica do eletrodo é representada na equação abaixo.
AgBr(s) + e ⇋ Ag(s) + Br - (aq)
A aplicação desse eletrodo em potenciometria é de
A determinação de glicose foi feita em quatro réplicas, isto é, n = 4, em uma amostra coletada em jejum. Os seguintes resultados foram obtidos: 91,0 mg dL-1 ; 95,0 mg dL-1 ; 96,0 mg dL-1 e 98,0 mg dL-1 , com desvio padrão 2,9 mg dL-1 . A distribuição dos dados tende à normalidade (com t = 3,2 para 3 graus de liberdade e com 95% de limite de confiança).
Considerando o valor médio e o intervalo de confiança do resultado, o valor mais próximo, em mg dL-1 , da maior concentração admitida para glicose na amostra é
Um procedimento gravimétrico foi realizado de acordo com as instruções da literatura. Um precipitado foi obtido após a mistura da solução de amostra com a solução do reagente precipitante (esta última adicionada em quantidade para garantir excesso estequiométrico). Por conta das características do precipitado, uma fração ficou suspensa na solução (suspensão coloidal) e foi perdida na filtragem para recolher o sólido. Após secagem, a massa final do precipitado foi medida em balança calibrada. O procedimento foi repetido três vezes para se obter um valor médio de massa de analito e seu desvio padrão.
Com relação aos erros associados ao resultado, tem-se
A reação representada abaixo é a titulação potenciométrica de Cr2+ com solução padrão de Ce4+, usando um eletrodo indicador de Pt.
Cr2+ + Ce4+ → Cr3+ + Ce3+
Antes do ponto de equivalência, quando a concentração de Cr2+ é 100 vezes maior que a de Cr3+, o potencial medido, em V (numa temperatura T em que RT/F = 0,06 V), é
Dados
Potenciais em relação ao eletrodo padrão de hidrogênio.
Cr3+ + e → Cr2+ Eo = - 0,41 V
Ce4+ + e → Ce3+ Eo
= +1,44 V
Os átomos de um determinado elemento químico têm a configuração eletrônica:
[configuração de um gás nobre] 3s2 3p1 .
O gás nobre que tem configuração eletrônica igual à configuração indicada entre colchetes é o
No procedimento de extração líquido-líquido, em um funil de extração, uma espécie química alvo (analito), dissolvida num solvente (denominado aqui de solvente original), é extraída para outro solvente (denominado aqui de solvente extrator) de diferente polaridade, tirando vantagem de uma partição favorável do analito para o solvente extrator. A constante de partição (Kf ) é dada pela razão entre as concentrações do analito no solvente extrator (Solv-ext) e no solvente original (Solv-orig).
Kf = [analito]Solv-ext. / [analito]Solv-orig.
Na determinação de níquel, presente na forma de porfirina de níquel em petróleo, a amostra foi diluída com MIBK (metilisobutilcetona ou, segundo a IUPAC, 4-metil-pentan-2-ona) antes de ser introduzida na chama de um espectrômetro de absorção atômica.
Considere as seguintes ações do analista na realização das análises:
I - usar uma lâmpada de catodo oco de níquel;
II - ajustar o feixe da lâmpada para passar na zona de combustão primária da chama;
III - quantificar usando curva analítica construída com soluções feitas com padrão metalorgânico de níquel dissolvido em MIBK;
IV - ajustar o fator de diluição da amostra em MIBK para que o sinal fique na faixa linear dinâmica da resposta analítica.
A(s) ação(ões) inapropriada(s) para obter um resultado analítico exato é(são) somente a(s)
Um copo Becher contém uma solução aquosa onde duas substâncias estão dissolvidas. Essa solução foi tratada com um reagente que formou um precipitado ao reagir com uma das substâncias. Todo o material foi transferido para um funil, com membrana, acoplado a um Kitasato conectado a uma torneira por uma trompa. Após filtragem, a solução do Kitassato foi transferida para um placa de Petri, que foi colocada numa estufa a 60°C. Após 24 h, o filme sólido na placa foi raspado e colocado em um frasco âmbar com tampa.
Com base no procedimento descrito, identificam-se quais métodos de separação?
Uma solução padrão de um corante foi colocada na cubeta de quartzo (1,00 cm de caminho óptico) de um espectrofotômetro. O percentual de radiação (em 550 nm) transmitida através da solução foi de 10%, valor já corrigido em relação à contribuição do solvente. A absortividade molar, em 550 nm, do corante é 10.000 L mol-1 cm-1 , e o resultado experimental se encontrava na faixa linear regida pela Lei de Beer-Lambert.
A concentração, em mol L-1 , do corante na solução é
O alumínio pode ser determinado por espectrofotometria de absorção após a formação do complexo colorido entre Al3+ e o corante vermelho de alizarina (AZR), que reagem na proporção de 1 para 1, em pH 3. A medição de absorvância foi feita em 480 nm, os valores medidos (já descontados do valor do branco) de quatro diferentes soluções padrões do complexo são mostradas na Tabela abaixo. A curva analítica obtida teve comportamento linear e passou pela origem — ponto (0,0).
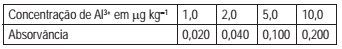
Uma solução de amostra de água de torneira foi analisada pelo método, e a absorvância líquida medida foi 0,070.
A concentração de Al3+, em μg kg-1, na solução de amostra é
A radiação eletromagnética na região do infravermelho não é suficientemente energética para promover transições eletrônicas, porém pode produzir transições nos estados vibracionais e rotacionais numa molécula. Considere a influência da radiação no infravermelho nas moléculas de: água, monóxido de carbono e amônia.
Observa-se somente vibração de estiramento APENAS nas moléculas de
As cromatografias líquida e gasosa são importantes técnicas analíticas que permitem a análise de amostras contendo várias espécies químicas.
Em um cromatograma típico, apresenta-se
Um volume igual a 2,00 mL de uma amostra de ácido muriático (ácido clorídrico comercial) foi transferido para um balão volumétrico e diluído, com água destilada, até o volume de 250,00 mL. Com auxílio de pipeta volumétrica, transferiu-se uma alíquota de 25,00 mL para um frasco Erlenmeyer contendo 100 mL de água. Essa alíquota foi titulada com solução aquosa padronizada de NaOH (0,100 mol L-1 ), e o ponto final, detectado com o indicador apropriado, foi atingido com 21,00 mL.
Nessas condições, a concentração, em mol L-1 , de HCℓ no ácido comercial é
O sal, contido em uma amostra de petróleo, foi extraído em água por meio de uma extração líquido-líquido. A solução aquosa obtida (em que o único sal dissolvido era o NaCℓ) foi diluída para 1000 mL com água, formando a denominada solução de amostra salina. Um volume de 100 mL desta solução foi adicionado a uma célula de um sistema de titulação coulométrica, contendo 500 mL de água, onde se manteve contínua agitação da solução com barra magnética. No anodo de prata da célula, a reação, representada abaixo, ocorre de forma completa por conta da aplicação de uma diferença de potencial.
Ag(s) + Cℓ-(aq) → AgCℓ(s) + e
A carga total envolvida na reação foi calculada a partir do gráfico.
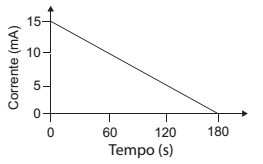
A concentração, em mol L-1 , de cloreto de sódio na solução de amostra salina era
Dado
A carga de 1 mol de elétrons é 96.500 C
O cloreto de potássio (KCℓ), um sal muito solúvel em água, é derivado de um ácido forte. Sobre o cloreto de potássio e sua solução aquosa, fazem-se as seguintes afirmações:
I - O cloreto de potássio é um sal derivado de base forte.
II - O cloreto de potássio não se dissocia quando colocado em água.
III - Numa solução aquosa de cloreto de potássio tem-se [OH- ] = [H+].
Está correto o que se afirma em:
Uma amostra de minério (5,00 g) foi completamente dissolvida em ácido e o volume ajustado para 100,00 mL. Uma alíquota de 10,00 mL dessa solução aquosa foi misturada, de forma lenta e sob agitação constante, com excesso de solução aquosa de hidróxido de amônio, suficiente para promover a precipitação completa de ferro na forma de Fe(OH)3 .
Fe3+ (aq) + 3OH- (aq) → Fe(OH)3 (s)
Após envelhecer, em sua água mãe, filtrar e lavar, o precipitado foi calcinado em forno mufla para formar Fe2O3 , que depois foi deixado para resfriar, em dessecador, até massa constante.
2 Fe(OH)3(s) → Fe2O3(s) + 3H2O(g)
Sendo a massa de Fe2O3(s), obtida após a calcinação, igual a 3,84 g, o valor mais próximo da percentagem (massa/ massa) de ferro no minério é
Dado
M (Fe) = 56 g mol-1
M (Fe2O3
) = 160 g mol-1