Questões de Concurso
Foram encontradas 8.680 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Julgue o item que se segue, acerca de modificações de superfícies de biomateriais com proteínas.
Uma das maneiras de proteger o implante de reações
adversas do sistema imunológico consiste em revesti-lo com
proteínas da matriz extracelular.
Julgue o item que se segue, acerca de modificações de superfícies de biomateriais com proteínas.
Todos os métodos de modificação de superfícies de
biomateriais são essencialmente métodos químicos.
Julgue o item que se segue, acerca de modificações de superfícies de biomateriais com proteínas.
Embora a maioria dos biomateriais sintéticos tenham
propriedades físicas que atendam ou até excedam as do
tecido natural, em algumas situações eles podem provocar
reações fisiológicas desfavoráveis, como trombose,
inflamação ou infecção.
Julgue o item que se segue, acerca de modificações de superfícies de biomateriais com proteínas.
No desenvolvimento de dispositivos médicos implantáveis
(como marca-passos e stents), uma das vantagens da
modificação de superfícies de biomateriais com proteínas é a
biocompatibilidade, uma vez que proteínas, por serem
moléculas biológicas, são automaticamente reconhecidas
pelo organismo hospedeiro.
Depois do arroz e do milho, a mandioca é a terceira maior fonte de carboidratos das populações nos trópicos do planeta, fazendo parte da dieta básica de mais de meio bilhão de pessoas. A mandioca-brava, todavia, pode ser fatal para quem a consome, devido à presença do glicosídeo de acetona cianoidrina. O glicosídeo em si não é venenoso, mas as enzimas do intestino humano, quando o decompõem, liberam cianeto de hidrogênio (HCN), conforme a reação mostrada a seguir, que ocorre em duas etapas.
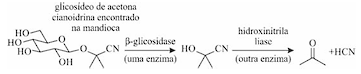
Jonathan Clayden, Nick Greeves e Stuart Warren. Organic Chemistry. 2. ed.
New York: Oxford University Press Inc., 2012 (tradução livre).
Uma pequena quantidade de HCN (a partir de 100 mg/kg
de mandioca) é suficiente para matar um ser humano após uma
refeição de mandioca não fermentada. Se, todavia, a mandioca
for esmagada com água e deixada em repouso, ela irá fermentar e
as enzimas da própria mandioca farão o mesmo trabalho e, então,
o HCN poderá ser eliminado antes de a mandioca ser cozinhada e
consumida — como o HCN é muito volátil, ele evapora na
temperatura de cozimento. A mandioca, após esse processo, é
segura para consumo, mas ainda contém algum glicosídeo.
Algumas doenças reportadas principalmente na África são
atribuídas ao consumo prolongado de mandioca-brava.
Tendo como referência inicial as informações e a imagem precedentes, julgue os itens a seguir.
Em uma solução alcalina, a segunda etapa da reação em tela
não necessitaria ser catalisada, pois isso seria uma condição
que favoreceria a conversão da cianoidrina em cetona, uma
vez que o cianeto é um bom grupo abandonador.
Depois do arroz e do milho, a mandioca é a terceira maior fonte de carboidratos das populações nos trópicos do planeta, fazendo parte da dieta básica de mais de meio bilhão de pessoas. A mandioca-brava, todavia, pode ser fatal para quem a consome, devido à presença do glicosídeo de acetona cianoidrina. O glicosídeo em si não é venenoso, mas as enzimas do intestino humano, quando o decompõem, liberam cianeto de hidrogênio (HCN), conforme a reação mostrada a seguir, que ocorre em duas etapas.

Jonathan Clayden, Nick Greeves e Stuart Warren. Organic Chemistry. 2. ed.
New York: Oxford University Press Inc., 2012 (tradução livre).
Uma pequena quantidade de HCN (a partir de 100 mg/kg
de mandioca) é suficiente para matar um ser humano após uma
refeição de mandioca não fermentada. Se, todavia, a mandioca
for esmagada com água e deixada em repouso, ela irá fermentar e
as enzimas da própria mandioca farão o mesmo trabalho e, então,
o HCN poderá ser eliminado antes de a mandioca ser cozinhada e
consumida — como o HCN é muito volátil, ele evapora na
temperatura de cozimento. A mandioca, após esse processo, é
segura para consumo, mas ainda contém algum glicosídeo.
Algumas doenças reportadas principalmente na África são
atribuídas ao consumo prolongado de mandioca-brava.
Tendo como referência inicial as informações e a imagem precedentes, julgue os itens a seguir.
Na conversão do glicosídeo em acetona, o átomo de carbono
ligado ao grupo cianeto muda sua hibridização de sp2
para
sp3
e, em decorrência disso, seus ângulos de ligação mudam
de cerca de 120° para cerca de 109°, fazendo, assim, que os
substituintes que ele carrega se aproximem.
Depois do arroz e do milho, a mandioca é a terceira maior fonte de carboidratos das populações nos trópicos do planeta, fazendo parte da dieta básica de mais de meio bilhão de pessoas. A mandioca-brava, todavia, pode ser fatal para quem a consome, devido à presença do glicosídeo de acetona cianoidrina. O glicosídeo em si não é venenoso, mas as enzimas do intestino humano, quando o decompõem, liberam cianeto de hidrogênio (HCN), conforme a reação mostrada a seguir, que ocorre em duas etapas.

Jonathan Clayden, Nick Greeves e Stuart Warren. Organic Chemistry. 2. ed.
New York: Oxford University Press Inc., 2012 (tradução livre).
Uma pequena quantidade de HCN (a partir de 100 mg/kg
de mandioca) é suficiente para matar um ser humano após uma
refeição de mandioca não fermentada. Se, todavia, a mandioca
for esmagada com água e deixada em repouso, ela irá fermentar e
as enzimas da própria mandioca farão o mesmo trabalho e, então,
o HCN poderá ser eliminado antes de a mandioca ser cozinhada e
consumida — como o HCN é muito volátil, ele evapora na
temperatura de cozimento. A mandioca, após esse processo, é
segura para consumo, mas ainda contém algum glicosídeo.
Algumas doenças reportadas principalmente na África são
atribuídas ao consumo prolongado de mandioca-brava.
Tendo como referência inicial as informações e a imagem precedentes, julgue os itens a seguir.
O tamanho dos substituintes desempenha papel central nas
reações orgânicas e é a razão pela qual os aldeídos são mais
reativos que as cetonas, por exemplo. O impedimento
estérico afeta as taxas de reação e também pode determinar o
mecanismo de reação.
Depois do arroz e do milho, a mandioca é a terceira maior fonte de carboidratos das populações nos trópicos do planeta, fazendo parte da dieta básica de mais de meio bilhão de pessoas. A mandioca-brava, todavia, pode ser fatal para quem a consome, devido à presença do glicosídeo de acetona cianoidrina. O glicosídeo em si não é venenoso, mas as enzimas do intestino humano, quando o decompõem, liberam cianeto de hidrogênio (HCN), conforme a reação mostrada a seguir, que ocorre em duas etapas.

Jonathan Clayden, Nick Greeves e Stuart Warren. Organic Chemistry. 2. ed.
New York: Oxford University Press Inc., 2012 (tradução livre).
Uma pequena quantidade de HCN (a partir de 100 mg/kg
de mandioca) é suficiente para matar um ser humano após uma
refeição de mandioca não fermentada. Se, todavia, a mandioca
for esmagada com água e deixada em repouso, ela irá fermentar e
as enzimas da própria mandioca farão o mesmo trabalho e, então,
o HCN poderá ser eliminado antes de a mandioca ser cozinhada e
consumida — como o HCN é muito volátil, ele evapora na
temperatura de cozimento. A mandioca, após esse processo, é
segura para consumo, mas ainda contém algum glicosídeo.
Algumas doenças reportadas principalmente na África são
atribuídas ao consumo prolongado de mandioca-brava.
Tendo como referência inicial as informações e a imagem precedentes, julgue os itens a seguir.
Na conversão de cianoidrinas em seus respectivos derivados
carbonilados, esperam-se melhores rendimentos para as
cianoidrinas aldeídicas que para as cianoidrinas cetônicas.
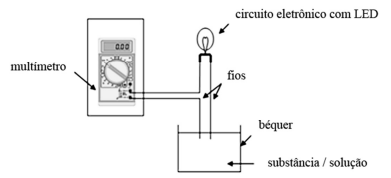
Figura. Sistema usado para indicar a passagem de corrente elétrica
W. S. de Araújo Rocha. Construção, aplicação e avaliação de um kit de experimentos para o ensino de eletrólitos. Dissertação. Mestrado Profissional em Química. Universidade Federal de São Carlos. UFSCAR. 2014.
De acordo com as informações do texto e da figura precedente, assinale a opção correta acerca do sistema mostrado na referida figura.
À luz das informações apresentadas, assinale a opção correta.
C5H11OH + O2 → CO2 + H2O
Com base nessa equação, assinale a alternativa correta.
( ) A teoria dos orbitais moleculares é a que melhor descreve a ligação química, pois resolve as deficiências da Teoria de Lewis e é mais simples na utilização dos cálculos quando comparada à Teoria de Valência.
( ) Nas ligações múltiplas, um átomo forma uma ligação “sigma” usando um orbital híbrido (sp ou sp2 ) e uma ou mais ligações “pi” usando orbitais não hibridados. A superposição lateral que produz uma ligação “pi” não restringe a rotação das moléculas, resultando em ligações mais fracas do que as ligações “sigma”, não impedindo que átomos maiores formem ligações múltiplas.
( ) Os diagramas de níveis de energia de orbitais moleculares de moléculas diatômicas heteronucleares são fáceis de predizer qualitativamente. Entretanto, são dificilmente calculados usando softwares específicos disponíveis.
( ) Na Teoria dos Orbitais Moleculares, todos os elétrons de valência estão deslocalizados sobre toda a molécula, isto é, não pertencem a alguma ligação específica.
A ordem correta de preenchimento dos parênteses, de cima para baixo, é:
( ) A variação de entalpia (ΔH) de um sistema informa a quantidade de calor trocado por esse sistema à pressão constante. O sinal de ΔH informa se o processo é exotérmico ΔH>0 ou endotérmico ΔH<0.
( ) A representação de uma equação termoquímica deve incluir os coeficientes estequiométricos de todos os participantes e o ΔH do processo.
( ) A entalpia padrão de formação (ΔH0f) é positiva para as substâncias simples, desde que estejam no estado-padrão, no estado físico e na variedade alotrópica mais estável.
( ) Os valores ∆H são numericamente iguais, mas de sinais opostos, para reações químicas que sejam o inverso uma da outra.
A ordem correta de preenchimento dos parênteses, de cima para baixo, é:
( ) Os monossacarídeos que contêm um grupo aldeído são classificados como aldoses, enquanto aqueles que apresentam um grupo cetona são classificados como cetoses.
( ) Sacarose e lactose são exemplos de monossacarídeos.
( ) Três polissacarídeos importantes, todos constituídos de unidades de glicose, são o amido, o glicogênio e a maltose.
( ) A celulose é um dissacarídeo amplamente distribuído nas estruturas de sustentação das plantas.
A ordem correta de preenchimento dos parênteses, de cima para baixo, é:
I. O ácido carbônico é um ácido forte que sofre decomposição em gás carbônico e água.
II. Dióxido de carbono e trióxido de enxofre são exemplos de óxidos ácidos.
III. Monóxido de carbono e monóxido de nitrogênio são exemplos de óxidos neutros.
IV. Mg(OH)2 e Al(OH)3 são bases comumente empregadas como antiácidos estomacais.
V. Al2O3 é um exemplo de óxido básico.
Quais estão corretas?