Questões de Concurso
Foram encontradas 8.680 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!

Observe a imagem a seguir:
Assinale a alternativa correta quanto ao gás gerado a partir do lixo, que pode ser usado para a produção de eletricidade.
1ª. Etapa: S + O2 → SO2 2ª. Etapa: SO2 + O2 → SO3 3ª. Etapa: SO3 + H2O → H2SO4
Ao fazermos o balanceamento para as 2ª e 3ª etapas, utilizando somente os menores coeficientes inteiros, assinale a alternativa correta.
Disponível em: Chuva ácida: como ocorre, causas e consequências - Toda Matéria (todamateria.com.br). Adaptado. (Acesso: 06/04/2023).
Com relação às chuvas ácidas é correto afirmar que:
(Adaptado. Disponível em: A QUÍMICA ORGÂNICA E O MEIO AMBIENTE NO ENSINO MÉDIO: REAÇÃO DE SAPONIFICAÇÃO COM ÓLEOS RESIDUAIS | Além dos Muros da Universidade (ufop.br). Acesso: 20/03/2023.
Neste contexto, assinale a alternativa que não está de acordo com os objetivos gerais do Ensino de Química na Educação Básica.
Adaptado. Disponível em: https://mundoeducacao.uol.com.br/quimica/atomo.htm#:~:text=O%2 0%C3%A1tomo%20%C3%A9%20a%20unidade,explicar%20o%20f uncionamento%20da%20mat%C3%A9ria. Acesso: 06/04/2023.
Observe o quadro abaixo:
1. Modelo do Pudim de Passas ( ) Partícula alfa (radioatividade) 2. Modelo da Bola de Bilhar ( ) Eletrólise (eletricidade) 3. Modelo Planetário (Sistema Solar) ( ) Massas (Leis Ponderais)
Neste contexto, marque a sequência correta entre o Modelo Atômico e os experimentos/ temas científicos realizados.
Adaptado. Disponível em: https://brasilescola.uol.com.br/o-quee/quimica/o-que-e-atomo.htm. Acesso: 06/04/2023.
Com relação aos modelos atômicos, assinale a alternativa correta.
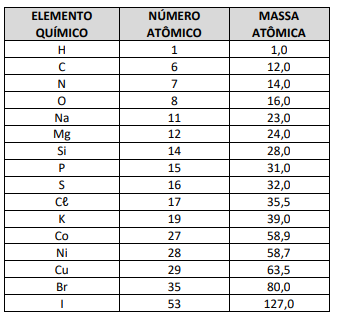
Coluna I 1. Possui caráter básico. 2. Em solução aquosa se ioniza. 3. Obtém-se na reação de neutralização. 4. Utilizado pelas plantas na fotossíntese.
Coluna II
( ) Sulfato de potássio ( ) Cloreto de hidrogênio ( ) Hidróxido de magnésio ( ) Gás carbônico
A sequência correta, de cima para baixo, é:

( ) O ácido bromídrico (HBr) é um hidrácido forte. ( ) O ácido fosfórico (H3PO4) é um oxiácido forte. ( ) O ácido hipocloroso (HCℓO) é um oxiácido fraco. ( ) O ácido iodídrico (HI) é um hidrácido fraco.
Está correta, de cima para baixo, a seguinte sequência:


Uma das formas da obtenção do gás nitrogênio é através da reação química do sódio com o nitrato de potássio. Sua equação química, não ajustada, é:
Na(s) + KNO3(s) → K2O(s) + Na2O(s) + N2(g).
Assinale a opção que corresponde aos coeficientes do par
das substâncias, reagente e produto.
A variação de energia livre relacionada à reação de combustão do etanol, apresentada pela equação a seguir, é mais próxima do comportamento descrito pela seguinte letra (correspondente no gráfico):
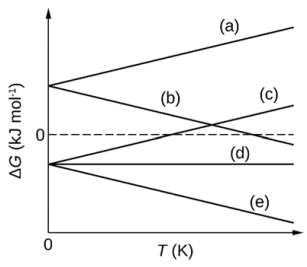
C2H5OH(l) + 3O2(g) → 2CO2(g) + 3H2O(g)
Ventura, D. O lendário azul da Prússia, cor que pode salvar ou tirar vidas. Disponível em www.bbc.com. Adaptado.
A distribuição eletrônica na valência do par associado à conversão eletroquímica de oxidação mencionada no texto é descrita por:
Analisando as propriedades mencionadas no texto, para o grupo 12 e partindo do zinco em direção ao mercúrio, é possível prever tendência de: