Questões de Concurso
Foram encontradas 8.687 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
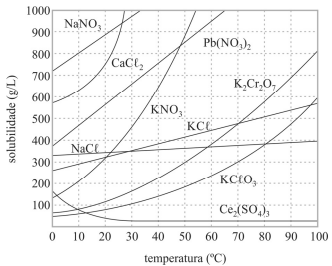
A 50 °C, uma solução de 100 mL que contém 80 g de KNO3 é classificada como insaturada.

Uma solução de cloreto de potássio a 10 °C possui concentração em quantidade de matéria superior a 4,2 mol/L.

Todos os compostos referenciados no gráfico apresentado são iônicos e apresentam elevadas temperaturas de fusão e ebulição.

Considere-se que uma solução de nitrato de sódio (NaNO3) tenha sido preparada a 20 °C, dissolvendo-se 1,00 mol de NaNO3 em 100 mL de água, e que, posteriormente, esse sistema tenha sido resfriado a 10 °C. Nesse caso, a massa do precipitado formado é superior a 40 g.

As dissoluções dos sais apresentados no gráfico são processos endotérmicos.
Para a eliminação completa de 12 mg de metanfetamina do corpo, são necessárias mais de 6 × 1020 moléculas de gás oxigênio.
Partindo das informações anteriores e considerando que MCO2 = 44,00 g/mol e MC10H15N = 149,00 g/mol sejam, respectivamente, as massas molares do CO2 e do C10H15N, e que a constante de Avogadro (NA) valha 6 × 1023 mol−1, julgue o item subsequente.
A soma das quantidades de matéria dos reagentes é igual à
soma das quantidades de matéria dos produtos.
Partindo das informações anteriores e considerando que MCO2 = 44,00 g/mol e MC10H15N = 149,00 g/mol sejam, respectivamente, as massas molares do CO2 e do C10H15N, e que a constante de Avogadro (NA) valha 6 × 1023 mol−1, julgue o item subsequente.
Para a eliminação completa de 16 mg de metanfetamina do
corpo, serão formados mais de 40 mg de gás carbônico,
considerando-se um rendimento de 80% desse processo.
Partindo das informações anteriores e considerando que MCO2 = 44,00 g/mol e MC10H15N = 149,00 g/mol sejam, respectivamente, as massas molares do CO2 e do C10H15N, e que a constante de Avogadro (NA) valha 6 × 1023 mol−1, julgue o item subsequente.
As moléculas triatômicas participantes da reação supracitada
possuem geometria linear.
Não procede a concepção reducionista da alquimia como práticas da Idade Média e do Renascimento que buscavam a transformação de metais menos nobres em ouro. Da mesma forma, não se pode simplificar dizendo-se que a transição da alquimia à química corresponde à ascensão da primeira em ciência. A alquimia, segundo algumas concepções, não pode ser considerada a origem da química, pois se restringia muito a concepções filosóficas da vida.
Internet:<http://www.qnesc.sbq.org.br/> (com adaptações).
Considerando o assunto do texto precedente, julgue o item que se segue.
A transformação de metais citada no texto assemelha-se
à atual transmutação dos elementos, como, por exemplo,
aquela que ocorre na síntese dos elementos com número
atômico maior que o do urânio na tabela periódica.
A adição de sal light à água, para o preparo de macarrão, diminui a temperatura de ebulição e aumenta a pressão máxima de vapor d’água, por isso ela ferveria mais rápido nessas condições.
A partir do texto apresentado, e considerando que as massas molares do NaCl e do KCl valham, respectivamente, 58,5 g/mol e 74,6 g/mol e que a constante de Avogadro valha 6 × 1023 mol−1, julgue o item a seguir.
A solução de sal light é classificada como eletrolítica e a sua
condutibilidade elétrica é tão maior quanto menor for a sua
concentração.
A partir do texto apresentado, e considerando que as massas molares do NaCl e do KCl valham, respectivamente, 58,5 g/mol e 74,6 g/mol e que a constante de Avogadro valha 6 × 1023 mol−1, julgue o item a seguir.
A concentração de íons Cl−
na solução de sal light preparada
conforme o texto é inferior a 0,05 mol/L.
A partir do texto apresentado, e considerando que as massas molares do NaCl e do KCl valham, respectivamente, 58,5 g/mol e 74,6 g/mol e que a constante de Avogadro valha 6 × 1023 mol−1, julgue o item a seguir.
Na solução de sal light preparada conforme o texto, estão
contidos 1,2 × 1022 íons de Na+
.