Questões de Concurso
Foram encontradas 8.687 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
I. As partículas se comportam tanto como onda e como partícula. II. As moléculas não influenciam umas às outras, nunca. III. As moléculas de um gás são pontos infinitesimalmente pequenos. IV. Um gás consiste em uma coleção de moléculas em movimento aleatório contínuo.
Estão corretas as afirmativas:
1. 40,0 mg de Ar está confinado em um frasco de 0,0500 l a 27°C. 2. 40,0 mg de Kr está confinado em um frasco diferente de 0,0500 l a 27ºC.
A constante universal dos gases é 8,314462 L.kPa.K-1.mol-1. Massa molar aproximada: Ar = 40 g/mol, Kr = 80 g/mol.
Sobre o assunto, analise as afirmativas a seguir.
I. Para ter a mesma pressão do Ar, o Kr tem que estar a 600K. II. Para que os 2 gases tenham a mesma pressão, as temperaturas do Ar e do Kr devem ser iguais. III. O número de mol (n) do Kr é o dobro do número de mols do At.
Estão corretas as afirmativas:
Considerando essa situação, assinale a alternativa que contenha as pressões finais dos dois gases corretas.
Considere a estrutura química da testosterona.
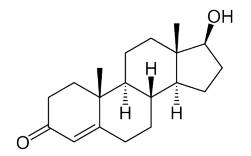
A massa molar para a estrutura química fornecida na imagem será, aproximadamente, de:
Dados de massas molares: C = 12 g/mol, H = 1 g/mol e O = 16 g/mol.
Dada a equação química
Fe + H2SO4 → Fe2(SO4)3 + H2
a soma de todos os menores coeficientes estequiométricos da
equação balanceada pelo método das tentativas é igual a
Compete ao nível representacional
A aula experimental em laboratório de química configura uma atividade cujo objetivo é exercitar a observação e evidenciar a transformação química, seja pela mudança de coloração, formação de precipitados ou liberação de gases.
O trecho foi extraído de uma apostila de aulas experimentais de química. Nesse experimento, o aluno deverá perceber a formação de um precipitado amarelo.
Com o desenvolvimento dessa atividade, o aluno poderá perceber e concluir sobre a possível ocorrência de uma reação
STRATHERN, Paul. O Sonho de Mendeleiev - A verdadeira história da Química. 2002. Zahar.
Assinale a opção que apresenta corretamente a Lei de Dalton.
Embora os fosfatos não apresentem toxicidade elevada, são excelentes nutrientes e favorecem a proliferação excessiva de algas e cianobactérias. Esse fenômeno é chamado eutrofização.
A esse respeito, assinale a afirmativa incorreta.
Essa diferença de valores pode ser explicada pelas diferenças de estrutura molecular dos dois compostos e de forças intermoleculares que atuam em cada líquido.
A esse respeito, assinale V para a afirmativa verdadeira e F para a falsa.
( ) ligações dipolo-induzido que se manifestam entre moléculas de 1-propanol são responsáveis pelo seu alto ponto de ebulição. ( ) ligações de hidrogênio mantém unidas as moléculas de metoxietano e são responsáveis pelo baixo ponto de ebulição. ( ) o ponto de ebulição do 1-propanol é maior devido à ação de forças de van der Waals.
As afirmativas são, respectivamente,
SO2Cl2 (g) → SO2 (g) + Cl2 (g)
A reação é conduzida em reator fechado, de 2,5L, contendo inicialmente 0,05 mol de SO2Cl2, a 600K. Dessa forma, a pressão inicial é de 1atm, totalmente devido ao reagente.
A reação segue cinética de primeira ordem, na qual o tempo de meia-vida, a 600K, é igual a 4,1h.
O tempo no qual a pressão total do sistema terá atingido um aumento de 87,5% é
Nesta temperatura, a constante de equilíbrio, Kc, vale 4.
O número de mols de acetato de etila presente no meio reacional após o equilíbrio ter sido atingido será, aproximadamente, igual a
0,700g de amostra foi digerido e alcalinizado com excesso de solução de hidróxido de sódio. Após destilação, a amônia foi coletada em 25,00mL de solução de ácido sulfúrico 0,0750mol L–1. A titulação do excesso do ácido requereu 5,00mL de solução de hidróxido de sódio 0,1250 mol L–1.
[Dados: Massa molar do nitrogênio = 14 g mol–1.]
O teor de nitrogênio na amostra é de
Em setembro de 2020, pesquisadores da Universidade de Cardiff, no Reino Unido, juntamente com o Instituto de Tecnologia de Massachusetts, nos Estados Unidos, anunciaram a possível descoberta de fosfina (PH3) na atmosfera de Vênus. A evidência de fosfina foi divulgada como um indicador de um novo processo inorgânico ou de atividade biológica microbiana em Vênus.
PH3 é uma molécula de geometria piramidal na qual as distâncias das ligações P−H são de 1,42 Å e os ângulos H−P−H são de 93,5°. Ela exibe um pequeno momento de dipolo, 0,58 D, em comparação com NH3 (1,47 D).
[Dados: Valores de eletronegatividade de Pauling: P: 2,19; H: 2,20.]
A esse respeito, assinale a afirmativa correta.
O preparo de uma solução envolveu as seguintes etapas:
1. Transferência de 5,0mL de solução aquosa de cloreto de magnésio 1,90 g L-1 a balão volumétrico de 25,0mL.
2. Adição de 10,0mL de solução aquosa de sulfato de sódio 0,015 mol L-1 ao mesmo balão.
3. O volume da solução final no balão volumétrico foi completado à 25,0mL como água destilada.
[Dados: massas molares (em g.mol–1 ). Mg: 24; Cl: 35,5; Na: 23; S: 32; O: 16.]
A concentração total de cátions, em mol L–1, na solução final será
de
O dimetilsulfeto, por exemplo, apresenta baixa solubilidade em água, mas é capaz de reagir com oxidantes atmosféricos na superfície de uma gotícula de água formando dimetilsulfóxido, que penetra na gotícula e continua na rota de oxidação até a formação de íons sulfato.
As gotículas de água e soluções aquosas dispersas na atmosfera são exemplos de dispersões classificadas como
(Fonte: https://www.cnnbrasil.com.br/saude/empresa-de-petiscos-para-animaissuspende-venda-por-contaminacao-por-etilenoglicol/, data de publicação: 19/10/2022; consultado em: 23/12/2022).
Recentemente essa e outras notícias similares veiculadas nas mídias alertaram a população sobre a contaminação de produtos para animais por etilenoglicol, um solvente orgânico altamente tóxico que causa insuficiência renal e hepática, podendo levar à morte, quando ingerido.
Apesar de sua alta toxicidade, ele é usado em diversos processos industriais em que a refrigeração a temperaturas próximas ou levemente inferiores a 0oC é necessária. Nessa temperatura, a água pura congelaria sob pressão atmosférica. Misturas água / etilenoglicol, entretanto, se mostram líquidas nessas condições.
Sobre a mudança de temperatura de congelamento da mistura, em relação à do solvente, é correto afirmar que o etilenoglicol