Questões de Concurso
Foram encontradas 8.687 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Considere as reações de P4O10 incompletas e não balanceadas:
I. P4O10 + a KOH → b K3PO4 + c H2O II. P4O10 + d HClO4 → e X + f H3PO4
A esse respeito, é correto afirmar que
A série do tório, por exemplo, inicia-se pela sequência:
• 232Th90 → 228Ra88 + α • 228Ra88 → AXZ + β • AXZ → 228Th90 + β
O produto da segunda equação química é um núcleo
A Cipermetrina é uma substância do grupo dos piretróides e possui classificação toxicológica nível II (altamente tóxica). É fotoestável, não se degradando com a luz solar. Atua como um potente inseticida, por contato ou ingestão, contra alvos biológicos que causam consideráveis danos a culturas como algodão, café, milho e soja.
A fórmula que representa a estrutura química da cipermetrina é mostrada a seguir.
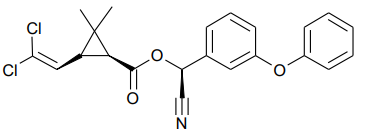
Nessa estrutura, é possível identificar os grupos funcionais
Entretanto, observa-se que, contrário à regra, os valores daprimeira energia de ionização dos átomos nitrogênio (Z = 7) eoxigênio (Z = 8) mostram EI(O) < EI(N):
• EI(N) = 1402 kJ mol-1 • EI(O) = 1314 kJ mol-1
Assinale a opção que justifica corretamente a relação entre osvalores de EI do nitrogênio e do oxigênio.
1. A quantização do momento angular. 2. O equilíbrio mecânico atingido pela igualdade dos módulos das forças elétrica (de atração do elétron ao núcleo) e centrípeta (do movimento circular do elétron em torno do núcleo).
Dessa forma, ele desenvolveu uma expressão para a energia que depende de um número quântico, n, que indica o nível de energia eletrônica e determina o raio.
A esse respeito, assinale V para a afirmativa verdadeira e F para a falsa.
( ) O modelo atômico de Bohr permitiu descrever com sucesso o raio do movimento circular do elétron em torno do núcleo de hidrogênio no estado fundamental. ( ) O modelo atômico de Bohr permitiu descrever com sucesso a diferença de energia entre dois níveis eletrônicos do átomo de hidrogênio. ( ) O modelo atômico de Bohr permitiu descrever com sucesso o comprimento de onda associado a excitações eletrônicas em átomos de qualquer número atômico.
As afirmativas são, respectivamente,
A fórmula química que representa sua estrutura é apresentada abaixo:
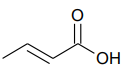
Uma solução aquosa de ácido crotônico foi preparada pela dissolução de 2,15g do ácido em água, sendo o volume final igual a 500mL.
[Dados: massas molares (em g.mol-1). C: 12; H: 1; O: 16.]
O pH dessa solução é igual a
Considere os dados termoquímicos:
B2H6(g) + 3 O2(g) → B2O3(s) + 3 H2O(g) ΔHo= -1941 kJ mol–1 2 B(s) + 3/2 O2(g) → B2O3(s) ΔHo= -2368 kJ mol–1 H2(g) + 1/2 O2(g) → H2O(g) ΔHo= -241,8 kJ mol–1
A entalpia padrão de formação do diborano (em kJ mol–1) é
[Dados. Potenciais de redução padrão:
E0Al3+|Al = -1,66 V; E0Cu2+|Cu = +0,34 V.]
Nessas condições, analise as afirmativas a seguir a respeito desse sistema eletroquímico:
I. Será uma pilha, pois a reação esperada é espontânea. II. A diferença de potencial esperada é 7,32V. III. Será uma reação espontânea se um potencial externo de 2,00V for aplicado ao sistema.
Está correto o que se afirma em
[Dados: massas molares (em g.mol-1). Metano: 16; Amônia: 17.]
Nesse caso, é correto afirmar que os recipientes contêm
A análise elementar de uma amostra revelou a seguinte composição: 58,5% de carbono, 4,1% de hidrogênio e 11,4 % de nitrogênio.
[Dados: massas molares (em g.mol-1): C: 12; H: 1; N: 14; O: 16.]
A fórmula mínima do composto na amostra é
Essa característica faz que uma solução de ácido sulfúrico de concentração 0,01 mol l-1 tenha um pH de ______ .
Assinale a alternativa que preench a correta e respectivamente as lacunas.
I. Em países onde o inverno é rigoroso, usa -se o NaCl nas estradas para abaixar o ponto de congelamento da água e retardar a formação do gelo. II. Na presença de um soluto, a temperatura de ebulição da água sobe (pouco) para 100,05º C na presença de 0,1M de sacarose. III. A água do mar possui uma temperatura de congelamento maior de 0º C devido à mistura de muitos sais dissolvidos.
Estão corretas as asserções :
I. São possíveis 9 combinações de moléculas de CO2 . II. A molécula mais leve é o que é encontrado em maior proporção. III. A molécula mais pesada encontrada é o 14C 18O2.
Assinale a alternativa correta .
I. O átomo de Ni possui um número atômico 28 e massa atômica 59, logo seu número de nêutrons é 28 pois é um átomo neutro. II. O Cl possui um número atômico de 17 e possui 2 isótopos naturais (35 e 37), logo seu número de nêutrons é de 18 e 20. III. O Cl- possui número atômico 17 e seus isótopos (35 e 37) possuem 16 e 18 nêutrons respectivamente. IV. O número de elétrons do Na+ é menor que o número de prótons de seu núcleo.
Estão corretas as asserções:
Assinale a alternativa que preencha correta e respectivamente as lacunas.
Assinale a alternativa que melhor representa quantas meias-vidas são necessárias para decompor 99% de uma amostra:
I. Os polímeros de adição necessariamente devem possuir uma dupla ligação nos seus monômeros constituintes. II. O monômero colrato de vinila polimeriza-se em policlorato de vinila (PVC). III. Polímeros de condensação são obtidos por reações em que um álcool reage com um ácido carboxílico ou um ácido reage com uma amina, porém ambos têm que ter dois grupos funcionais para haver a reação de polimerização.
Estão corretas as afirmativas:
Considere a reação entre o ácido acético (CH3COOH) e o álcool etílico (CH3CH2OH) em meio ácido e analise as afirmativas a seguir.
I. Essa reação forma o acetato de metila, pois produz, além do éster, o metanol. II. A água oriunda dessa reação vem do grupo hidroxila do ácido e do hidrogênio do etanol. III. Essa reação forma o acetato de etila e água. IV. Para se obter um bom rendimento, uma forma é deslocando a reação para o sentido dos produtos, retirando a água do meio.
Estão corretas as asserções: