Questões de Concurso
Foram encontradas 8.725 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Acerca da produção de etanol, julgue o item a seguir.
Fermentação e destilação são as únicas operações unitárias
envolvidas no processo de produção de etanol.
Acerca da produção de etanol, julgue o item a seguir.
Um microrganismo comumente utilizado no processo de
fermentação alcoólica é a levedura Saccharomyces
cerevisae.
Acerca da produção de etanol, julgue o item a seguir.
O processo de produção de etanol envolve a hidroformilação
de moléculas de glicose.
O número de átomos de carbono presentes na fórmula molecular do flurbiprofeno é igual a
CH3NH2(aq) + H2O(l) ⇆ CH3NH3+ (aq) + OH–(aq)
Sabe-se que o valor da constante de ionização da metilamina (Kb) é igual a 3,6 x 10-4 e que seu grau de ionização é inferior a 5%. Assim, uma solução aquosa de metilamina que seja comercializada com concentração 0,10mol.L-1 deve apresentar pH igual a
(Dados: log 2 = 0,30 e log 3 = 0,50)
I. possuem baixos ponto de fusão, ponto de ebulição e densidade. II. reagem violentamente com água, gerando como produtos uma base e gás hidrogênio. III. perdem elétrons com facilidade, tendendo a formar íons monovalentes.
Possuem essas características os elementos químicos pertencentes ao grupo
• 2KClO3 (s) → 2 KCl (s) + 3 O2 (g) • 2 KHCO3 (s) → K2O (s) + H2O (g) + 2 CO2 (g) • K2CO3 (s) → K2O (s) + CO2 (g)
Nas condições reacionais empregadas, o rendimento foi de 100% e produziu 1,80 g de água, 19,2 g de gás oxigênio e 22,0 g de gás carbônico.
Os percentuais aproximados de KClO3, KHCO3 e K2CO3 na amostra inicial são, respectivamente, iguais a
Observe a tabela a seguir que contém os valores de pKa para cinco ácidos inorgânicos distintos.
ÁCIDO pKa carbônico 6,37 hipocloroso 7,53 hipobromoso 8,69 bórico 9,14 cianídrico 9,31
O ácido mais forte é o
S2O8 2 – (aq) + 3 I – (aq) → 2 SO4 2 – (aq) + I3 – (aq)
A tabela a seguir contém dados experimentais sobre a reação em condições específicas de temperatura e pressão.
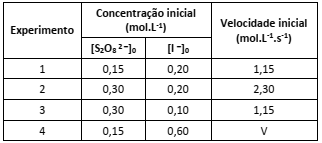
A partir das informações apresentadas é possível prever que a velocidade (V) do Experimento 4 será
A partir dessas novas leis foi possível determinar a(o)
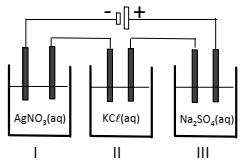
Cada cuba era constituída por um par de eletrodos inertes, continham soluções aquosas de AgNO3, KCl e Na2SO4 de mesma concentração e operaram durante um mesmo período de tempo em iguais condições.
A partir dessas informações, assinale V para a afirmativa verdadeira e F para a falsa.
( ) Na cuba I observa-se formação de gás no cátodo.
( ) Na cuba II o pH da solução aumenta ao longo do processo. ( ) Na cuba III um depósito sólido é formado no ânodo.
As afirmativas são, respectivamente,
A reação global do processo de transmutação descrito pode ser representada po
2 POCl3(g) → 2 PCl3(g) + O2(g)
Nas condições-padrão a 298 K, a variação de entalpia (ΔH0 ) e a variação de entropia (ΔS 0 ) para esse processo valem, respectivamente, 572 kJ e 179 J/K. A partir das informações apresentadas, analise as afirmações a seguir.
I. O processo de decomposição do cloreto de fosforila é endotérmico. II. O processo leva à diminuição da desordem do sistema. III. O processo é não-espontâneo nas condições-padrão.
Está correto apenas o que se afirma em
2HF(aq) + C2O42-(aq) ⇆ 2F-(aq) + H2C2O4(aq) Keq
Sabe-se ainda que
(I) HF(aq) ⇆ H+ (aq) + F– (aq) K1
(II) H2C2O4 (aq) ⇆ 2H+ (aq) + C2O4 2– (aq) K2
O valor da constante de equilíbrio Keq pode ser expresso em função das constantes K1 e K2 pela expressão
Cu(s) + NO3 – (aq) + H+ (aq) → Cu+2(aq) + NO(g) + H2O(l)
A soma dos menores inteiros que balanceiam corretamente a equação descrita é igual a
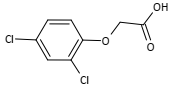
No composto U 46 BR são identificadas as funções