Questões de Concurso
Comentadas para técnico de laboratório - química
Foram encontradas 1.045 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Observe as estruturas dos ácidos abaixo:
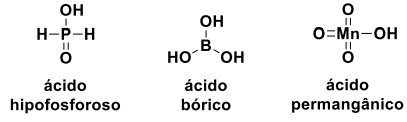
Sobre esses ácidos, analise as seguintes afirmações:
1. O ácido hipofosforoso possui três hidrogênios ionizáveis.
2. No ácido permangânico, o número de oxidação do Mn é +7.
3. O ácido bórico possui hibridação sp2 e geometria trigonal plana.
4. Devido à presença do metal, o ácido permangânico é o mais fraco.
Estão corretas, apenas:
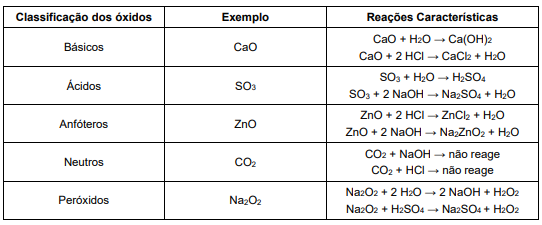
Ao observar a tabela, o professor precisou explicar ao estudante que um exemplo estava errado e não correspondia à classificação sugerida. A categoria cujo exemplo está incorreto é a dos óxidos:
Usado para a limpeza de peças e ferramentas, o ácido muriático é uma solução impura de ácido clorídrico e pode ser encontrado em lojas de materiais de construção. Com o objetivo de determinar a concentração de um lote desse produto em termos de porcentagem de HCl (m/V), um químico reagiu uma alíquota de 50mL do ácido muriático comercial com carbonato de cálcio em excesso, conforme a reação:
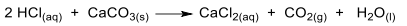
Nesse experimento, o volume coletado de CO2 foi 6,15L a 27oC e 1 atm. Qual é a porcentagem de HCl (m/V) na amostra de ácido muriático?
Massas molares (g/mol): H = 1; C = 12; O = 16; Cl = 35,5; Ca = 40
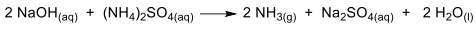
Considere que, em uma indústria química, são colocados em um reator 60kg de NaOH, 66kg de (NH4)2SO4 e água suficiente para solubilizar os reagentes. A reação ocorre até que um dos reagentes seja completamente consumido. Considerando as CNTP, o volume obtido de NH3(g) é:
Massas molares (g/mol): H = 1; O = 16; N = 14; Na = 23; S = 32

Considerando que essa reação tem um rendimento de 90%, calcule a massa de alumínio necessária para a produção de 11,2 kg de ferro para solda.
Massas molares (g/mol): O = 16; Al = 27; Fe = 56.

A reação não está balanceada. Faça o balanceamento, considerando os menores inteiros como coeficientes reacionais. A soma desses coeficientes é igual a:
Dados: densidade Hg(l) = 13,6 kg/dm3 ; massa molar Hg = 200 g/mol; considere o número de Avogadro = 6 x 1023
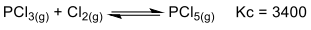
Considere que a reação acima está em equilíbrio e que as concentrações de PCl3 e Cl2 são 1,0 x 10-3 molL-1 e 1,0 x 10-2 molL-1 , respectivamente. Nessas condições, a pressão de PCl5 no equilíbrio será:
Considere os dados da tabela abaixo:

De acordo com os dados acima, o ânion que atua como base mais forte é:
Dados: log 2 = 0,3 e log 3 = 0,48
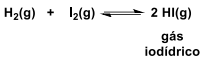
Considere um reator de 10L em que inicialmente são colocados 0,9 mol de H2(g) e 0,9 mol de I2(g) na temperatura T. Quando o equilíbrio for atingido, a concentração molar de HI(g) no equilíbrio será de:
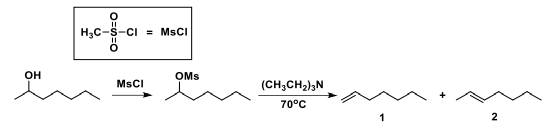
Sobre a etapa de eliminação, é correto afirmar que:
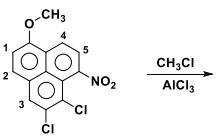
Na alquilação proposta acima, o grupo metil entrará preferencialmente na posição assinalada com:
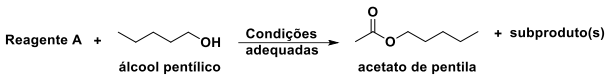
Considerando o esquema da reação acima, qual substância NÃO poderia ser utilizada como o “Reagente A”?
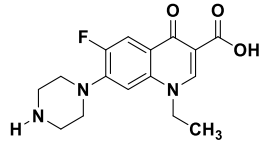
Nessa molécula NÃO está presente a função:
1. pesou o objeto em uma balança analítica observando uma massa igual a 57,8499 g;
2. colocou 40,0mL de água em uma proveta;
3. mergulhou o objeto na água e observou a nova marcação do volume igual a 48,1mL;
4. pesquisou as densidades desses metais na literatura especializada:
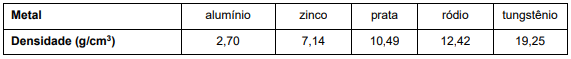
A partir desses dados, é possível concluir que o objeto é constituído de:
Massas molares em g/mol: C = 12; O = 16; Ca = 40
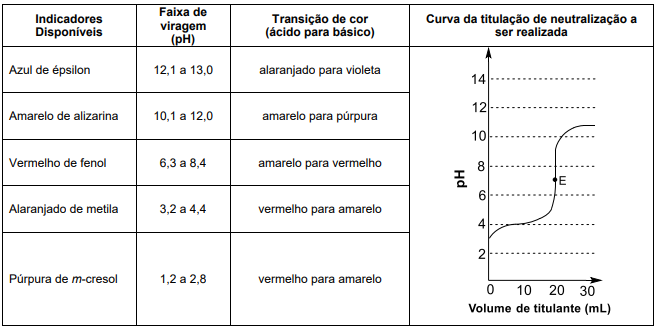
O indicador que o técnico deve utilizar é:

Nessa localidade há um rio em que ocorre despejo de efluentes industriais de uma empresa do ramo metalúrgico. Em um procedimento de fiscalização, uma amostra desse efluente foi coletada para análise e identificou-se a presença tanto de íons Cr2+ como de íons Hg2+ em concentrações de 1,0 x 10-3 g/L e 1,5 x 10-3 g/L, respectivamente. Considerando a densidade da amostra igual a 1g/cm3 , é correto afirmar que: