Questões de Concurso
Comentadas para químico
Foram encontradas 1.645 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
A respeito de ácidos e bases, julgue o item a seguir.
Quanto mais forte for a base, mais fraco será o seu ácido
conjugado.
A respeito de ácidos e bases, julgue o item a seguir.
Por ser um ácido forte, o ácido fluorídrico é muito corrosivo.
A respeito de ácidos e bases, julgue o item a seguir.
O BF3 é uma base de Lewis porque o elemento boro (B)
pode receber um par de elétrons.
A respeito de ácidos e bases, julgue o item a seguir.
Um ácido de Brønsted é um receptor de próton.
Acerca de ligações químicas e estruturas moleculares, julgue o item seguinte.
A estrutura de Lewis para o íon tetrafluoroborato (BF4 − ) é a mostrada a seguir.
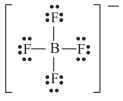
Acerca de ligações químicas e estruturas moleculares, julgue o item seguinte.
O físico-químico Gilbert Newton Lewis propôs a regra do
octeto.
Acerca de ligações químicas e estruturas moleculares, julgue o item seguinte.
O físico-químico Gilbert Newton Lewis explicou o modelo
das ligações químicas.
No que se refere aos fundamentos dos métodos espectroscópicos de análise, julgue o próximo item.
A maioria dos compostos aromáticos não heterocíclicos não
substituídos apresentam rendimentos quânticos de
fluorescência elevados o suficiente para uma análise bem
sucedida por espectroscopia de fluorescência. Moléculas
com sistemas de vários anéis aromáticos e com estruturas
planares rígidas costumam apresentar alta fluorescência.
No que se refere aos fundamentos dos métodos espectroscópicos de análise, julgue o próximo item.
As bandas de absorção são normalmente muito mais amplas
nos espectro de UV-VIS que nos de infravermelho (IV).
No que se refere aos fundamentos dos métodos espectroscópicos de análise, julgue o próximo item.
Vários tipos de transições entre níveis de energia
quantizados dão origem aos espectros moleculares de
UV-VIS, entre as quais se destacam as transições n → π* e
π → π*, porque envolvem grupos funcionais característicos
das substâncias e comprimentos de onda que são facilmente
acessíveis.

A figura anterior mostra a curva de titulação de uma
amostra que pode conter NaOH, Na2CO3 e NaHCO3, em
quaisquer proporções, em que o titulante é HCl 0,100 mol/L.
Com relação a essa situação hipotética e considerando os intervalos de viragem de alguns indicadores, informados na tabela precedente, julgue o item subsequente.
Se a curva de titulação tivesse apenas um ponto de inflexão
negativa, então seria correto concluir que a amostra conteria
apenas NaOH.

A figura anterior mostra a curva de titulação de uma
amostra que pode conter NaOH, Na2CO3 e NaHCO3, em
quaisquer proporções, em que o titulante é HCl 0,100 mol/L.
Com relação a essa situação hipotética e considerando os intervalos de viragem de alguns indicadores, informados na tabela precedente, julgue o item subsequente.
Ácidos fracos podem ser determinados por titulometria de
neutralização, mas não os ânions deles derivados.

A figura anterior mostra a curva de titulação de uma
amostra que pode conter NaOH, Na2CO3 e NaHCO3, em
quaisquer proporções, em que o titulante é HCl 0,100 mol/L.
Com relação a essa situação hipotética e considerando os intervalos de viragem de alguns indicadores, informados na tabela precedente, julgue o item subsequente.
É adequado utilizar púrpura de bromocresol e azul de timol
como indicadores, do primeiro e do segundo pontos de
equivalência, respectivamente.

A figura anterior mostra a curva de titulação de uma
amostra que pode conter NaOH, Na2CO3 e NaHCO3, em
quaisquer proporções, em que o titulante é HCl 0,100 mol/L.
Com relação a essa situação hipotética e considerando os intervalos de viragem de alguns indicadores, informados na tabela precedente, julgue o item subsequente.
A amostra em apreço contém apenas NaOH e Na2CO3.
Considere que, em uma determinação de alumínio por volumetria de complexação com ácido etilenodiaminotetracético (EDTA), em uma série de nove replicatas de uma amostra que contém 10,77% de Al2O3, chegou-se a uma média da porcentagem de Al2O3 de 10,79% e um desvio padrão de 0,0415%. Sabendo que o parâmetro t de Student para 95% de confiança e oito graus de liberdade é dado por t95 = 2,31, julgue o item seguinte, com relação a essa situação hipotética.
Uma das vantagens de utilizar EDTA como agente
complexante em volumetria de complexação é que ele é um
quelante muito seletivo.
Considere que, em uma determinação de alumínio por volumetria de complexação com ácido etilenodiaminotetracético (EDTA), em uma série de nove replicatas de uma amostra que contém 10,77% de Al2O3, chegou-se a uma média da porcentagem de Al2O3 de 10,79% e um desvio padrão de 0,0415%. Sabendo que o parâmetro t de Student para 95% de confiança e oito graus de liberdade é dado por t95 = 2,31, julgue o item seguinte, com relação a essa situação hipotética.
O intervalo de confiança para 95% de certeza da análise
dessas replicatas é corretamente expresso como
10,79 (± 0,01) %.
Considere que, em uma determinação de alumínio por volumetria de complexação com ácido etilenodiaminotetracético (EDTA), em uma série de nove replicatas de uma amostra que contém 10,77% de Al2O3, chegou-se a uma média da porcentagem de Al2O3 de 10,79% e um desvio padrão de 0,0415%. Sabendo que o parâmetro t de Student para 95% de confiança e oito graus de liberdade é dado por t95 = 2,31, julgue o item seguinte, com relação a essa situação hipotética.
A diferença observada entre o valor tido como verdadeiro e a
média experimental é significativa e deve ser atribuída a um
erro constante.
Considere que, em uma determinação de alumínio por volumetria de complexação com ácido etilenodiaminotetracético (EDTA), em uma série de nove replicatas de uma amostra que contém 10,77% de Al2O3, chegou-se a uma média da porcentagem de Al2O3 de 10,79% e um desvio padrão de 0,0415%. Sabendo que o parâmetro t de Student para 95% de confiança e oito graus de liberdade é dado por t95 = 2,31, julgue o item seguinte, com relação a essa situação hipotética.
Em volumetria de complexação, o indicador forma um
segundo complexo com o analito, que normalmente é
colorido. Quando o titulante é adicionado, ele complexa
primeiro com o metal livre na solução até que este acabe. Ele
passa então a deslocar o metal complexado com o indicador,
alterando a cor da solução e indicando o ponto final da
titulação.
Acerca de métodos eletroquímicos de análise, julgue o item que se segue.
Um dos problemas da utilização do mercúrio como eletrodo
de trabalho é a existência de picos em curvas de
corrente-voltagem, denominados máximos polarográficos,
atribuídos à convecção que ocorre nas adjacências da gota de
mercúrio crescente. A adição de pequenas quantidades de um
tensoativo à solução de análise normalmente elimina esses
máximos. Porém, é preciso ter cuidado, pois o excesso de
supressor de máximos pode alterar a viscosidade da solução
e reduzir as correntes de difusão necessárias para o bom
funcionamento do eletrodo.
Acerca de métodos eletroquímicos de análise, julgue o item que se segue.
Em potenciometria, é necessário o uso de três eletrodos: o
eletrodo de trabalho, o eletrodo de referência e o eletrodo
auxiliar.