Questões de Concurso
Comentadas para químico
Foram encontradas 1.646 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
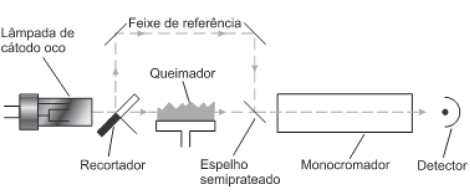
SKOOG, D. WEST, D. M. HOLLER, F. J. CROUCH, S. R Fundamentos de Química Analítica. 8 ed. São Paulo. Cengage Learning. 2010.
Ao considerar a instrumentação e os princípios da técnica analítica em si, analise as afirmações a seguir: I. A lâmpada de cátodo oco, consiste de um ânodo de tungstênio e de um cátodo cilíndrico selado em um tubo de vidro, contendo um gás inerte, como o monóxido de dinitrogênio. II. Como em toda a investigação relativa, há a necessidade de estipular um branco para a análise, já que no queimador podem surgir partículas que influem no sinal detectado e de natureza diferentes das que constituem a amostra analisada. III. A temperatura da chama é responsável pelas etapas de dessolvatação, vaporização e dissociação, bem como a conversão dos íons contidos na amostra em átomos neutros, estes últimos são os responsáveis por absorver o feixe de radiação.
É correto apenas o que se afirma em:
Um medicamento à base de ferro pode ter sua concentração conhecida por espectrofotometria UV/ Visível. Utilizando-se um medicamento de referência, realizaram-se as devidas diluições para a construção de uma curva de calibração. As medidas de absorbância, no comprimento de onda de absorção máxima de 510 nm, nas diferentes concentrações do medicamento de referência encontram-se na tabela a seguir:
Concentração (ppm) Absorbância
2,00 0,164
5,00 0,425
8,00 0,628
12,00 0,951
16,00 1,260
20,00 1,582
Os dados obtidos permitiram a construção de uma curva de calibração com coeficiente de correlação (R2) de 0,99978 e equação da reta: A = 0,01478 + 0,07812 x C. Sabendo-se que a absorbância da solução do medicamento à base de ferro foi de 0,715. Analise as propostas:
I. A concentração da amostra analisada é de 8,96 ppm.
II. O analito deve ser colorido, pois o comprimento de onda é na região do visível.
III. A absorbância está relacionada diretamente com a quantidade de radiação que atravessou a amostra analisada.
IV. A curva de calibração construída não se mostrou linear para o trecho estudado.
V. Se a amostra apresentar um valor de absorbância de 1,782 a concentração será de 22,60 ppm.
São corretas:
A análise quantitativa por espectrofotometria UV/Visível é muito utilizada para doseamento de determinados princípios ativos e corantes em formulações farmacêuticas disponíveis no mercado. Essa análise é confiável desde que obedeça a Lei de Beer, ou seja, a solução analisada deve obrigatoriamente seguir uma relação linear entre a absorbância e a concentração.
Considere a análise de um determinado fármaco que obedece a Lei de Beer. O que aconteceria com o valor de Absorbância se a concentração da solução do fármaco fosse o dobro? Considere que para esta análise utilizou-se uma cubeta de 1,00 cm de caminho óptico. O que aconteceria com o valor de Absorbância se uma nova medida fosse realizada com uma cubeta de 5,00 cm de caminho óptico?
O ácido perclórico P.A. apresenta concentração de 70%, sabendo que a densidade do ácido perclórico é 1,68g/cm-3 , assinale a alternativa que apresente o volume aproximado de solução do ácido que deve ser adicionado a um balão volumétrico de 200mL, afim de preparar uma solução 0,1 mol/L.
Dados M=100,46g.mol-1
Um cilindro contém uma mistura de 88 g de CO2(g) com uma quantidade desconhecida de gás argônio foi mantido em determinadas condições de pressão e temperatura.
Depois de vários testes, descobriu-se que com a adição de 220g de CO2(g) à mistura, mantendo-se temperatura e pressão constantes, o volume dobra.
Assinale a alternativa que apresenta a quantidade de argônio existente na mistura.
Dados: Massa atômica: Ar=40u; C=12u; O=16u
As características químicas da água ocorrem em função da presença de substâncias dissolvidas, geralmente mensuráveis apenas por meios analíticos.
Relacione a COLUNA II com a COLUNA I associando os indicadores químicos das águas às suas propriedades.
COLUNA I
1. Dureza
2. Alcalinidade
3. Corrosividade
4. Salinidade
COLUNA II
( ) Indicador caracterizado pela presença de ácidos minerais ou soluções de oxigênio que atuam sobre os metais.
( ) Característica conferida à água pela presença de sais de metais alcalino-terrosos e alguns outros metais em menor quantidade.
( ) Presença na água de substâncias como bicarbonatos, cloretos e sulfatos, conferindo a ela um sabor característico.
( ) Característica decorrente da presença de bicarbonatos, carbonatos e hidróxidos, quase sempre de metais alcalinos ou alcalino-terrosos.
Assinale a sequência correta.
Considere que um estudante misturou 20 mL de uma solução aquosa de HCl 1,0 mol/L com 20 mL de uma solução aquosa de NaOH 1,0 mol/L em um calorímetro. A temperatura da mistura reacional aumentou de 20 ºC para 28 ºC.
Partindo do princípio que a perda de calor da mistura reacional para o ambiente é desprezível e que o volume total da mistura é 40 mL, é correto afirmar que a variação da entalpia da reação é mais próxima de
Dados:
Calor específico (c) do meio reacional é igual a 4,18 J/g K.
Densidade (d) da mistura é igual a 1,0 g/mL.
A lei de absorção, também conhecida como Lei de Beer, diz quantitativamente como a grandeza da atenuação depende da concentração das moléculas absorventes e da extensão do caminho sobre o qual ocorre a absorção. A transmitância T da solução é a fração da radiação incidente transmitida pela solução.
Considerando que um feixe de radiação, ao passar por uma solução absorvente, registrou uma absorbância X, é correto afirmar que a transmitância será igual a
Considere que em uma amostra de água fluvial foi analisada a concentração de Fe+2 por meio da titulação redox. Para isso retirou-se uma alíquota de 50 mL da amostra da água, que foi titulada com uma solução-padrão de KMnO4 0,10 mol/L em meio ácido.
Se 20 mL da solução de permanganato são necessários para atingir o ponto final da titulação, a concentração de íon ferro (II), em mol/L, na água fluvial, é igual a
Na área de estudo da potenciometria, sabe-se que o eletrodo indicador é um dispositivo que, imerso na solução contendo o analito, desenvolve um potencial, que depende da atividade do analito. A maioria dos eletrodos indicadores empregados na potenciometria é seletiva em sua resposta.
Um eletrodo que é classificado como eletrodo indicador é o
Analise a situação a seguir.
Em um preparo de 100 mL de uma solução de ácido clorídrico (HCl) 0,1 mol/L, um técnico retirou da solução estoque 1 mL e completou com água até a linha de aferição.
Considerando que a densidade da solução estoque era 1,1 g/mL, qual a porcentagem aproximada em massa do ácido que estava contida no estoque?
Uma série natural de decaimento radioativo começa com uma espécie radioativa que, ao emitir radiações alfa, beta e / ou gama, forma uma espécie mais estável.
Considere que um mol de um elemento radiativo emitiu sete mols de partículas alfa e quatro mols de partículas beta produzindo um mol de um elemento mais estável.
Nesse contexto, qual processo reacional nuclear pode representar esse decaimento radioativo?
A formação de complexos é usada de muitas maneiras em Química Analítica . A análise química nessa área pode ser utilizada, por exemplo, para medir a quantidade de um analito, para controlar a quantidade efetiva deste que está disponível para outras reações ou como ferramenta para separação de substâncias químicas.
Considerando esse contexto, avalie as seguintes afirmativas e a relação proposta entre elas.
I. A formação de complexos é uma reação na qual ocorre uma ligação reversível entre duas ou mais espécies químicas distintas, como por exemplo, a amônia e Cu2+,
POR QUE
II. nesse caso o NH3 fornece um par de elétrons para os orbitais externos de um íon Cu2+, formando um complexo entre a amônia e o íon metálico, característico de uma reação ácido-base de Lewis.
A respeito dessas afirmativas e da relação proposta entre elas, assinale a alternativa correta.
Em análises químicas, os erros sistemáticos têm um valor definido e uma causa justificável, sendo da mesma ordem de grandeza para réplicas de medidas realizadas de maneira semelhante. Existem três tipos de erros sistemáticos: instrumentais, no método e do operador.
Entre os exemplos a seguir, aquele que é considerado um erro instrumental é:
As propriedades das substâncias aumentam sua magnitude de acordo com os tipos de interações entre moléculas predominantes.
Nesse sentido, é correto afirmar que as forças intermoleculares são fortes quando se têm menores
Os métodos potenciométricos de análises se baseiam na medida do potencial de células eletroquímicas, sem o consumo apreciável de corrente. Há cerca de um século, as técnicas potenciométricas têm sido utilizadas para localizar o ponto final em titulações.
Considere que em uma titulação potenciométrica de 10 mL de ácido clorídrico (HCl), a partir de um padrão de NaOH 0,10 mol/L, os resultados experimentais foram estimados utilizando o método da primeira derivada, conforme descrito no gráfico a seguir.
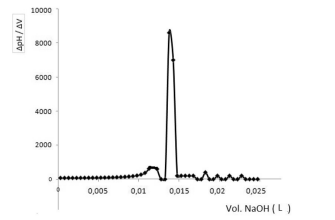
Nesse contexto, a concentração de ácido clorídrico em
mol/L titulado por hidróxido de sódio é igual a
Considerada como técnica analítica bem-sucedida, a espectrometria de absorção atômica é uma das mais utilizadas na determinação de elementos em baixas concentrações, que estão presentes em uma variedade de amostras, líquidas, sólidas, em suspensão ou até mesmo gasosas.
Sobre a técnica de espectrometria de absorção atômica, assinale com V as afirmativas verdadeiras e com F as falsas.
( ) A técnica de absorção atômica pode ser aplicada para quantificar vários elementos ao mesmo tempo.
( ) Instrumentos de absorção atômica utilizam um plasma de alta temperatura para atomização e excitação da amostra.
( ) A determinação de espécies atômicas somente é feita em meio gasoso, no qual os átomos individuais ou íons elementares se encontram bem espaçados uns dos outros.
( ) As análises quantitativas pela técnica de absorção atômica são baseadas em calibração com padrões externos e não devem ser fundamentadas na medida de um único padrão, presumindo que a Lei de Beer esteja sendo obedecida.
Assinale a sequência correta.
A Aspirina, como é conhecida o ácido acetilsalicílico (C9H8O4), é um fármaco que apresenta propriedades antitérmicas, anti-inflamatórias e analgésicas. Esse fármaco pode ser sintetizado pela reação entre o ácido salicílico (C7H6O3) e o anidrido acético (C4H6O3), catalisada por um ácido.
A equação a seguir representa o processo de síntese da aspirina.
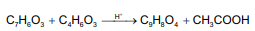
Considere, hipoteticamente, que 3 g de ácido salicílico foram misturados com 6 mL de uma solução de anidrido acético cuja densidade e grau de pureza são 1,2 g/mL e 80% m/m, respectivamente.
Se o rendimento da reação química é 100%, qual a
massa aproximada de aspirina produzida em gramas?
Disponível em: <https://super.abril.com.br/mundo-estranho/ quais-as-consequencias-da-saida-do-reino-unido-da-uniao europeia/>. Acessado em: 31 de outubro de 2019 (Adaptação).
Embora as consequências da saída do reino Unidos não estejam claras, a conclusão desse processo implicaria uma série de possíveis desdobramentos no Reino Unido, entre os quais está o(a)
Disponível em: <https://brasil.elpais.com/brasil/2019/10/14/ internacional/1571042788_418131.html>. Acesso em: 21 out. 2019 (Adaptação).
A origem do conflito de que trata o texto está no
