Questões de Concurso
Comentadas para perito criminal
Foram encontradas 1.364 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Tendo em vista que a inclusão de marcadores fotoluminescentes em munição livre de chumbo faz que o disparo de munição marcada dessa maneira produza resíduos luminescentes facilmente identificáveis na presença de luz ultravioleta, julgue o item subsequente, relacionado ao fenômeno de fotoluminescência envolvido nessa aplicação.
A fosforescência é um processo fotofísico lento, pois envolve uma transição radioativa entre estados de mesma multiplicidade.
Tendo em vista que a inclusão de marcadores fotoluminescentes em munição livre de chumbo faz que o disparo de munição marcada dessa maneira produza resíduos luminescentes facilmente identificáveis na presença de luz ultravioleta, julgue o item subsequente, relacionado ao fenômeno de fotoluminescência envolvido nessa aplicação.
A absorção de energia por uma molécula ocorrerá somente se
as distâncias internucleares nos seus estados fundamental e
excitado forem iguais.
A fotoluminescência é um fenômeno que envolve unicamente transições entre níveis eletrônicos na matéria.
Tendo em vista que, do ponto de vista prático, a quimiometria permite planejar ou selecionar condições ótimas de medidas e experimentos e, com isso, extrair o máximo de informação de dados químicos, julgue o item seguinte, relativo a esse assunto e a aspectos a ele correlacionados.
Para se fazer uma avaliação sistemática dos efeitos de
duas temperaturas, duas pressões e duas concentrações de
reagentes sobre o rendimento de uma reação química genérica
devem ser realizados, pelo menos, oito experimentos.
Se o espectro de absorção UV-vis da solução de um certo composto puro apresentar duas transições eletrônicas, então as absorvâncias nesse espectro estarão altamente correlacionadas e dependerão apenas de um único fator, a concentração.
Considerando que a análise de uma amostra de minério de chumbo tenha apresentado os seguintes resultados percentuais (%): 8,10; 8,32; 8,12; 8,22; 7,99; 8,31, julgue o item a seguir, relativo a esses dados.
O coeficiente de variação da análise é dado pela razão entre o
desvio padrão e a média, multiplicada por 100%
Considerando que a análise de uma amostra de minério de chumbo tenha apresentado os seguintes resultados percentuais (%): 8,10; 8,32; 8,12; 8,22; 7,99; 8,31, julgue o item a seguir, relativo a esses dados.
A variância dos dados em apreço é dada pelo valor do desvio padrão ao quadrado.
Considerando que a análise de uma amostra de minério de chumbo tenha apresentado os seguintes resultados percentuais (%): 8,10; 8,32; 8,12; 8,22; 7,99; 8,31, julgue o item a seguir, relativo a esses dados.
O desvio padrão da análise em apreço é dado pela raiz
quadrada do valor médio dividido pelo número de amostras, no
caso, 6.
O valor médio do teor de chumbo presente na amostra foi superior a 8%.

Com base no diagrama apresentado e na teoria dos orbitais moleculares (TOM), julgue o item subsecutivo.
De acordo com a TOM, o íon molecular O2+
possui ordem de
ligação maior do que a molécula neutra de O2.

A TOM mostra que, no estado fundamental de energia, a molécula de O2 apresenta todos os elétrons emparelhados e, por esse motivo, não apresenta comportamento magnético.

Com base nas informações e na figura apresentadas e considerando que a configuração eletrônica do íon Fe2+ é d6 , julgue o próximo item, de acordo com a teoria do campo cristalino.
Na hemoglobina com uma molécula de H2O substituindo a
molécula de O2, a energia de estabilização do campo cristalino
é igual a - 0,4 × Δoct, em que Δoct é o valor do desdobramento
do campo cristalino.

Com base nas informações e na figura apresentadas e considerando que a configuração eletrônica do íon Fe2+ é d6 , julgue o próximo item, de acordo com a teoria do campo cristalino.
A oxiemoglobina possui 4 elétrons desemparelhados e, por este
motivo, apresenta comportamento paramagnético.

A partir das informações fornecidas, conclui-se que a molécula de H2O é um ligante de campo mais fraco do que a molécula de O2.

A figura precedente mostra o gráfico do coeficiente de compressibilidade (Z) dos gases O2 e CO2 em função da pressão para a temperatura T2. Considerando a situação hipotética apresentada e as informações fornecidas, que a constante universal dos gases seja igual a 0,082 atm × L × mol-1 × K-1 , que a 300 K e 1,00 atm o O2 (g) e o CO2 (g) apresentem comportamento de gás ideal, e que a 300 atm e a uma temperatura T2 o O2 (g) e o CO2 (g) obedeçam a equação de estado de van der Waals expressa como: 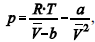 julgue o item que segue.
julgue o item que segue.
A temperatura T2 é inferior àquela verificada imediatamente
antes da compressão.
A seguir são apresentadas informações referentes à reação de decomposição do H2O2.


Considerando que a reação de decomposição do H2O2 seja exotérmica e se processe de acordo com uma cinética de primeira ordem, e que a constante universal dos gases seja igual a 8,3 J × mol-1 × K-1 , julgue o item subsequente, acerca da reação em questão.
As entalpias padrão de ligação fornecidas permitem determinar que a decomposição de 1,00 mol de H2O2, quando realizada à pressão constante de 1 bar e a 25 ºC, libera quantidade de calor superior a 100 kJ.
A seguir são apresentadas informações referentes à reação de decomposição do H2O2.


Considerando que a reação de decomposição do H2O2 seja exotérmica e se processe de acordo com uma cinética de primeira ordem, e que a constante universal dos gases seja igual a 8,3 J × mol-1 × K-1 , julgue o item subsequente, acerca da reação em questão.
A reação de decomposição do H2O2 libera maior quantidade de calor quando é realizada à pressão constante de 1 bar do que quando é realizada a volume constante.
A seguir são apresentadas informações referentes à reação de decomposição do H2O2.


Considerando que a reação de decomposição do H2O2 seja exotérmica e se processe de acordo com uma cinética de primeira ordem, e que a constante universal dos gases seja igual a 8,3 J × mol-1 × K-1 , julgue o item subsequente, acerca da reação em questão.
Em temperaturas mais elevadas, o valor da constante de
equilíbrio da reação de decomposição do H2O2 é superior ao
verificado em temperaturas mais baixas.
A seguir são apresentadas informações referentes à reação de decomposição do H2O2.


Considerando que a reação de decomposição do H2O2 seja exotérmica e se processe de acordo com uma cinética de primeira ordem, e que a constante universal dos gases seja igual a 8,3 J × mol-1 × K-1 , julgue o item subsequente, acerca da reação em questão.
O fato de a reação de decomposição do H2O2 ser de primeira
ordem implica tratar-se de uma reação elementar.
A seguir são apresentadas informações referentes à reação de decomposição do H2O2.


Considerando que a reação de decomposição do H2O2 seja exotérmica e se processe de acordo com uma cinética de primeira ordem, e que a constante universal dos gases seja igual a 8,3 J × mol-1 × K-1 , julgue o item subsequente, acerca da reação em questão.
O tempo necessário para que a concentração de H2O2 caia a
10% do valor inicial equivale a 10 × ek
, em que k é a constante
de velocidade da reação de decomposição do H2O2.